к приказу Министерства здравоохранения
Российской Федерации
от 10 ноября 2025 г. N 658н
ТРЕБОВАНИЯ
К ЗАПОЛНЕНИЮ ФОРМЫ НАПРАВЛЕНИЯ СВЕДЕНИЙ,
ИНФОРМАЦИИ И ДОКУМЕНТОВ, УЧИТЫВАЮЩИХ ОТРАСЛЕВЫЕ
ОСОБЕННОСТИ РАБОТ, ВЫПОЛНЯЕМЫХ В ИНТЕРЕСАХ
ЗДРАВООХРАНЕНИЯ, О ПРОЕКТЕ НАУЧНОЙ ТЕМЫ ПО НАУЧНЫМ
ИССЛЕДОВАНИЯМ (РАЗРАБОТКАМ), О НАУЧНО-ИССЛЕДОВАТЕЛЬСКОЙ,
ОПЫТНО-КОНСТРУКТОРСКОЙ И ТЕХНОЛОГИЧЕСКОЙ РАБОТЕ
ГРАЖДАНСКОГО НАЗНАЧЕНИЯ, К ВЫПОЛНЕНИЮ КОТОРОЙ СУБЪЕКТЫ
НАУЧНОЙ И (ИЛИ) НАУЧНО-ТЕХНИЧЕСКОЙ ДЕЯТЕЛЬНОСТИ
И СУБЪЕКТЫ ИННОВАЦИОННОЙ ДЕЯТЕЛЬНОСТИ НЕЗАВИСИМО
ОТ ИХ ОРГАНИЗАЦИОННО-ПРАВОВОЙ ФОРМЫ И ФОРМЫ СОБСТВЕННОСТИ
ПРИСТУПИЛИ В СЛУЧАЯХ, ПРЕДУСМОТРЕННЫХ АБЗАЦЕМ ВТОРЫМ ПУНКТА
2 ПОЛОЖЕНИЯ О ЕДИНОЙ ГОСУДАРСТВЕННОЙ ИНФОРМАЦИОННОЙ СИСТЕМЕ
УЧЕТА НАУЧНО-ИССЛЕДОВАТЕЛЬСКИХ, ОПЫТНО-КОНСТРУКТОРСКИХ
И ТЕХНОЛОГИЧЕСКИХ РАБОТ ГРАЖДАНСКОГО НАЗНАЧЕНИЯ,
УТВЕРЖДЕННОГО ПОСТАНОВЛЕНИЕМ ПРАВИТЕЛЬСТВА
РОССИЙСКОЙ ФЕДЕРАЦИИ ОТ 12 АПРЕЛЯ 2013 Г. N 327
ТРЕБОВАНИЯ
К ЗАПОЛНЕНИЮ ФОРМЫ НАПРАВЛЕНИЯ СВЕДЕНИЙ,
ИНФОРМАЦИИ И ДОКУМЕНТОВ, УЧИТЫВАЮЩИХ ОТРАСЛЕВЫЕ
ОСОБЕННОСТИ РАБОТ, ВЫПОЛНЯЕМЫХ В ИНТЕРЕСАХ
ЗДРАВООХРАНЕНИЯ, О ПРОЕКТЕ НАУЧНОЙ ТЕМЫ ПО НАУЧНЫМ
ИССЛЕДОВАНИЯМ (РАЗРАБОТКАМ), О НАУЧНО-ИССЛЕДОВАТЕЛЬСКОЙ,
ОПЫТНО-КОНСТРУКТОРСКОЙ И ТЕХНОЛОГИЧЕСКОЙ РАБОТЕ
ГРАЖДАНСКОГО НАЗНАЧЕНИЯ, К ВЫПОЛНЕНИЮ КОТОРОЙ СУБЪЕКТЫ
НАУЧНОЙ И (ИЛИ) НАУЧНО-ТЕХНИЧЕСКОЙ ДЕЯТЕЛЬНОСТИ
И СУБЪЕКТЫ ИННОВАЦИОННОЙ ДЕЯТЕЛЬНОСТИ НЕЗАВИСИМО
ОТ ИХ ОРГАНИЗАЦИОННО-ПРАВОВОЙ ФОРМЫ И ФОРМЫ СОБСТВЕННОСТИ
ПРИСТУПИЛИ В СЛУЧАЯХ, ПРЕДУСМОТРЕННЫХ АБЗАЦЕМ ВТОРЫМ ПУНКТА
2 ПОЛОЖЕНИЯ О ЕДИНОЙ ГОСУДАРСТВЕННОЙ ИНФОРМАЦИОННОЙ СИСТЕМЕ
УЧЕТА НАУЧНО-ИССЛЕДОВАТЕЛЬСКИХ, ОПЫТНО-КОНСТРУКТОРСКИХ
И ТЕХНОЛОГИЧЕСКИХ РАБОТ ГРАЖДАНСКОГО НАЗНАЧЕНИЯ,
УТВЕРЖДЕННОГО ПОСТАНОВЛЕНИЕМ ПРАВИТЕЛЬСТВА
РОССИЙСКОЙ ФЕДЕРАЦИИ ОТ 12 АПРЕЛЯ 2013 Г. N 327
1. Форма направления сведений, информации и документов, учитывающих отраслевые особенности работ, выполняемых в интересах здравоохранения, о проекте научной темы по научным исследованиям (разработкам), о научно-исследовательской, опытно-конструкторской и технологической работе гражданского назначения, к выполнению которой субъекты научной и (или) научно-технической деятельности и субъекты инновационной деятельности независимо от их организационно-правовой формы и формы собственности приступили в случаях, предусмотренных абзацем вторым пункта 2 Положения о единой государственной информационной системе учета научно-исследовательских, опытно-конструкторских и технологических работ гражданского назначения, утвержденного постановлением Правительства Российской Федерации от 12 апреля 2013 г. N 327 (далее соответственно - проект тематики, тематика, работа, отраслевые сведения, форма направления отраслевых сведений), заполняется в единой государственной информационной системе учета научно-исследовательских, опытно-конструкторских и технологических работ <1> (далее - государственная информационная система) в случае, если проект тематики планируется выполнять или работа выполняется в интересах здравоохранения, за исключением проектов тематик (работ), относящихся к фундаментальным или поисковым научным исследованиям.
--------------------------------
<1> Положение о единой государственной информационной системе учета научно-исследовательских, опытно-конструкторских и технологических работ гражданского назначения, утвержденное постановлением Правительства Российской Федерации от 12 апреля 2013 г. N 327.
2. Форма направления отраслевых сведений заполняется на русском языке при размещении в государственной информационной системе форм направления сведений, информации и документов о проектах научных тем по научным исследованиям (разработкам) и направления сведений, информации и документов о научно-исследовательской, опытно-конструкторской и технологической работе гражданского назначения, к выполнению которой субъекты научной и (или) научно-технической деятельности и субъекты инновационной деятельности независимо от их организационно-правовой формы и формы собственности приступили в случаях, предусмотренных абзацем вторым пункта 2 Положения о единой государственной информационной системе учета научно-исследовательских, опытно-конструкторских и технологических работ гражданского назначения, утвержденного постановлением Правительства Российской Федерации от 12 апреля 2013 г. N 327 <2> (далее - форма направления сведений).
--------------------------------
<2> Утверждены приказом Министерства науки и высшего образования Российской Федерации от 6 февраля 2023 г. N 108 "Об утверждении форм направления сведений, информации и документов, указанных в пункте 3 Положения о единой государственной информационной системе учета научно-исследовательских, опытно-конструкторских и технологических работ гражданского назначения, утвержденного постановлением Правительства Российской Федерации от 12 апреля 2013 г. N 327, требований к заполнению и направлению указанных форм" (зарегистрирован Министерством юстиции Российской Федерации 10 апреля 2023 г., регистрационный N 72958) с изменениями, внесенными приказами Министерства науки и высшего образования Российской Федерации от 16 апреля 2025 г. N 349 (зарегистрирован Министерством юстиции Российской Федерации 21 мая 2025 г., регистрационный N 82261) и от 13 августа 2025 г. N 637 (зарегистрирован Министерством юстиции Российской Федерации 29 августа 2025 г., регистрационный N 83388).
3. Все поля формы направления отраслевых сведений обязательны к заполнению, за исключением случаев, предусмотренных настоящими требованиями.
4. В раздел I формы направления отраслевых сведений включаются следующие сведения:
1) в пункте 1 "Вид работ (услуг), составляющих медицинскую деятельность, в интересах которого реализуется проект тематики (работа)" указываются код и наименование вида работ (услуг), составляющих медицинскую деятельность <3>, в интересах которого реализуется проект тематики (работа), с использованием справочника федерального реестра нормативно-справочной информации в сфере здравоохранения <4>;
--------------------------------
<3> Приложение к Положению о лицензировании медицинской деятельности, утвержденному постановлением Правительства Российской Федерации от 1 июня 2021 г. N 852 "О лицензировании медицинской деятельности (за исключением указанной деятельности, осуществляемой медицинскими организациями и другими организациями, входящими в частную систему здравоохранения, на территории инновационного центра "Сколково") и признании утратившими силу некоторых актов Правительства Российской Федерации".
<4> Положение о единой государственной информационной системе в сфере здравоохранения, утвержденное постановлением Правительства Российской Федерации от 9 февраля 2022 г. N 140.
2) в подпункте 1.1 пункта 1 "Вид работ (услуг), составляющих медицинскую деятельность, в интересах которого реализуется проект тематики (работы) (дополнительно к указанному в пункте 1 раздела I настоящей формы)" указываются (при наличии) дополнительно к указанному в пункте 1 раздела I формы направления отраслевых сведений код и наименование вида работ (услуг), составляющих медицинскую деятельность <3>, в интересах которого реализуется проект тематики (работа), с использованием справочника федерального реестра нормативно-справочной информации в сфере здравоохранения <4>;
3) в пункте 2 "Решаемые в результате выполнения проекта тематики (работы) отраслевые проблемы" в краткой свободной форме описываются решаемые в результате реализации проекта тематики (работы) конкретные отраслевые проблемы;
4) в пункте 3 "Гипотеза (идея) исследования (разработки), реализуемого (реализуемой) в рамках проекта тематики (работы), предпосылки и обоснования целесообразности такой реализации" в краткой свободной форме описывается гипотеза (идея) исследования (разработки) с ее обоснованием и приведением собственных данных и данных из литературных источников, обосновывающих целесообразность реализации проекта тематики (работы), включая постановку решаемой задачи, необходимость и возможность ее решения, а также описание выбранных путей (способов) решения поставленной задачи;
5) в пункте 4 "Дизайн исследования (разработки), реализуемого (реализуемой) в рамках проекта тематики (работы)" в краткой свободной форме описывается дизайн исследования (разработки) и его методология. В случае если тематикой (работой) предусмотрено получение (сбор) данных, описываются способ получения (сбора) данных, методы их анализа и интерпретации. В случае планируемого выявления при реализации тематики (работы) статистических закономерностей приводятся описание статистических методов анализа, в том числе используемого программного обеспечения, детальные расчеты и обоснования размеров выборок, включая сведения, необходимые для проверки правильности указанных расчетов;
6) в пункте 5 "Дизайн исследования (разработки), реализуемого (реализуемой) в рамках проекта тематики (работы), предполагает участие в нем человека" сведения заполняются посредством выбора поля "предполагает" или поля "не предполагает" в зависимости от участия человека в исследовании (разработке) в качестве объекта исследования;
7) в подпункте 5.1 пункта 5 "Этические аспекты реализации проекта тематики (работы), связанные с участием в исследовании (разработке) человека" приводится описание этических аспектов, связанных с исследованиями (разработками).
Сведения подпункта 5.1 пункта 5 не включаются в случае выбора в пункте 5 раздела I формы направления отраслевых сведений поля "не предполагает";
8) в подпункте 5.2 пункта 5 "Соответствие исследования (разработки), реализуемого (реализуемой) в рамках проекта тематики (работы), российскому законодательству и (или) международным договорам и актам, составляющим право Евразийского экономического союза" приводится перечень этапов исследования (разработки) с участием человека, реализация которых должна осуществляться в соответствии с требованиями законодательства Российской Федерации и (или) требованиями международных договоров и актов, составляющих право Евразийского экономического союза, с указанием соответствующих отношений с участником исследования (разработки), являющихся предметом указанного регулирования, в том числе требованиям о наличии разрешения на проведения клинических исследований (испытаний) лекарственных препаратов или медицинских изделий.
Сведения подпункта 5.2 пункта 5 не включаются в случае выбора в пункте 5 раздела I формы направления отраслевых сведений поля "не предполагает";
9) в пункте 6 "Перечень ожидаемых результатов проекта тематики (работы) и применимых на практике продуктов, на получение которых направлен (направлена) проект тематики (работа) (далее соответственно - ожидаемый результат, продукт)" указываются сведения для каждого ожидаемого результата, получение которого планируется в результате реализации тематики (работы) или на получение которого направлена тематика (работа), к окончанию срока реализации тематики (работы) посредством заполнения для каждого результата отдельной строки таблицы пункта 6 с указанием:
порядкового номера продукта в графе "N п/п";
кода типа продукта, на получение которого направлен (направлена) проект тематики (работа), в графе "Код типа продукта";
наименования типа продукта, на получение которого направлен (направлена) проект тематики (работа), в графе "Наименование типа продукта";
краткого текстового описания ожидаемого результата выполнения тематики (работы) в графе "Краткое наименование результата, получение которого запланировано к окончанию срока реализации тематики (работы)".
Краткое текстовое описание ожидаемого результата должно содержать сведения о типе, назначении и степени завершенности продукта, на получение которого направлен ожидаемый результат, к окончанию срока реализации тематики (работы).
Сведения пункта 6 включаются не менее чем для одного ожидаемого результата.
5. Раздел II формы направления отраслевых сведений заполняется для каждого ожидаемого результата, указанного в пункте 6 раздела I формы направления отраслевых сведений.
6. В раздел II формы направления отраслевых сведений для каждого результата проекта тематики (работы), указанного в пункте 7 раздела I формы направления отраслевых сведений, включаются следующие сведения:
1) в пункте 1 "Тип продукта" автоматически вносятся системой код типа продукта и наименование типа продукта в соответствии со сведениями пункта 6 раздела I формы направления отраслевых сведений для соответствующего ожидаемого результата;
2) в пункте 2 "Краткое наименование ожидаемого результата, получение которого запланировано к окончанию срока реализации тематики (работы)" автоматически вносятся системой краткое текстовое описание ожидаемого результата в соответствии со сведениями пункта 6 раздела I формы направления отраслевых сведений для соответствующего ожидаемого результата;
3) в пункте 3 "Код (коды) заболевания (состояния) в соответствии с Международной статистической классификацией болезней и проблем, связанных со здоровьем (далее - МКБ), в целях профилактики, диагностики, лечения и (или) реабилитации которого предназначен продукт" указываются один или более код и (или) диапазоны кодов МКБ, для профилактики, диагностики, лечения и (или) реабилитации которых предназначен допущенный к применению лекарственный препарат, медицинское изделие, биомедицинский клеточный продукт или включенный в клинические рекомендации метод профилактики, диагностики, лечения или реабилитации, на разработку которого направлена тематика (работа), или заболеваний (состояний), для которых в рамках тематики (работы) создается модель заболевания или выявляется мишень для терапии, с использованием справочника федерального реестра нормативно-справочной информации в сфере здравоохранения <4>.
Сведения пункта 3 не включаются для ожидаемых результатов, отнесенных к типу продукта "Научные исследования в целях обеспечения экспертной деятельности" или "Научные исследования в интересах организации здравоохранения и общественного здоровья". Для ожидаемых результатов, отнесенных к типу продукта "Выводы (рекомендации) для принятия управленческих решений на основании популяционных данных, эпидемиологических данных", внесение сведений в пункт 3 осуществляется в случае, если разрабатываемые выводы (рекомендации) непосредственно связаны с отдельными заболеваниями (состояниями);
4) в пункте 4 "Уровень готовности технологии" включаются сведения по уровням готовности разрабатываемых или разработанных технологий (далее - УГТ) и научным и (или) научно-техническим и (или) иным результатам (далее - результаты УГТ), соответствующим каждому УГТ. Внесение сведений по УГТ осуществляется в соответствующих типу продукта разделах справочника УГТ государственной информационной системы посредством выбора ранее достигнутых и планируемых к достижению при выполнении тематики (работы) результатов УГТ базового рубрикатора результатов УГТ раздела справочника УГТ, соответствующего типу продукта, из числа результатов УГТ, достижение которых является обязательным для достижения соответствующего УГТ, и результатов УГТ, достижение которых не является обязательным для достижения соответствующего УГТ.
Сведения в поле "Значение УГТ" строки "на начало выполнения тематики (работы)" вносятся системой автоматически на основании введенных сведений о ранее полученных результатах УГТ, являющихся обязательными для достижения соответствующего УГТ (на начало выполнения тематики (работы), рассчитываясь по формуле:
ai - число ранее полученных результатов УГТ, соответствующих i-му УГТ технологий и являющихся обязательными для достижения соответствующего УГТ;
bi - число обязательных для достижения результатов УГТ, соответствующих i-му УГТ.
Сведения в поле "Значение УГТ" строки "по итогам выполнения тематики (работы)" вносятся системой автоматически на основании введенных сведений о ранее полученных и запланированных к получению в рамках выполнения тематики (работы) результатах УГТ, являющихся обязательными для достижения соответствующего УГТ (по итогам выполнения тематики (работы), рассчитываясь по формуле:
ci - число ранее полученных и запланированных к получению в рамках выполнения тематики (работы) результатов УГТ, соответствующих i-му УГТ и являющихся обязательными для достижения соответствующего УГТ;
bi - число обязательных для достижения результатов УГТ, соответствующих i-му УГТ.
Сведения пункта 4 не вносятся для ожидаемых результатов, отнесенных к типам продуктов "Научные исследования в целях обеспечения экспертной деятельности", "Научные исследования в интересах организации здравоохранения и общественного здоровья", "Выводы (рекомендации) для принятия управленческих решений на основании популяционных данных, эпидемиологических данных", по которым внесение сведений по УГТ не предусмотрено. Для ожидаемых результатов, отнесенных к типу продукта "Иное", сведения по УГТ вносятся в соответствии с формами направления сведений;
5) в подпункте 4.1 пункта 4 "Ожидаемый результат является" сведения заполняются посредством выбора поля "применимым на практике продуктом" или поля "промежуточным этапом создания продукта";
6) в пункте 5 "Описание ожидаемого результата" в краткой свободной форме описывается ожидаемый результат с указанием его типа, состава (формы), назначения, области и особенностей использования (применения), степени завершенности к окончанию срока выполнения тематики (работы) с кратким описанием содержательной составляющей ожидаемого результата.
Сведения пункта 5 не вносятся в случае выбора в подпункте 4.1 пункта 4 поля "промежуточным этапом создания продукта";
7) в пункте 6 "Ожидаемый срок готовности продукта к практическому применению (год)" указывается год планируемого получения продукта, который может быть применен на практике, в том числе с учетом условий допуска к применению в соответствии с законодательством Российской Федерации (в случае наличия таких условий);
8) в пункте 7 "Описание продукта" в краткой свободной форме описывается применимый на практике продукт с указанием его типа, состава (формы), назначения, области и особенностей использования (применения);
9) в подпункте 7.1 пункта 7 "Код анатомо-терапевтическо-химической классификации (далее - АТХ), рекомендованной Всемирной организацией здравоохранения, и фармакотерапевтическая группа, к которой относится лекарственный препарат" с использованием справочника федерального реестра нормативно-справочной информации в сфере здравоохранения <4> указываются код анатомо-терапевтическо-химической классификации (далее - АТХ) и фармакотерапевтическая группа, к которой относится лекарственный препарат.
Сведения подпункта 7.1 пункта 7 не включаются для продуктов, не являющихся лекарственными препаратами;
10) в подпункте 7.2 пункта 7 "Группа/подгруппа, к которой относится медицинское изделие" с использованием справочника федерального реестра нормативно-справочной информации в сфере здравоохранения <4> указываются номер группы/подгруппы и наименование подгруппы, к которому относится медицинское изделие, в соответствии с перечнем групп и подгрупп медицинских изделий номенклатурной классификации медицинских изделий <5>.
--------------------------------
<5> Утверждена приказом Министерства здравоохранения Российской Федерации от 6 июня 2012 г. N 4н (зарегистрирован Министерством юстиции Российской Федерации 9 июля 2012 г., регистрационный N 24852) с изменениями, внесенными приказами Министерства здравоохранения Российской Федерации от 25 сентября 2014 г. N 557н (зарегистрирован Министерством юстиции Российской Федерации 17 декабря 2012 г., регистрационный N 35201), от 7 июля 2020 г. N 686н (зарегистрирован Министерством юстиции Российской Федерации 10 августа 2020 г., регистрационный N 59225) и от 24 июня 2025 г. N 364н (зарегистрирован Министерством юстиции Российской Федерации 5 августа 2025 г., регистрационный N 83136).
Сведения подпункта 7.2 пункта 7 не включаются для продуктов, не являющихся медицинскими изделиями;
11) в пункте 8 "Проблема, на решение которой направлен продукт" в краткой свободной форме описывается проблема в сфере здравоохранения, на решение которой направлен продукт или в решение которой внесет вклад продукт при его практическом применении;
12) в подпункте 9.1 пункта 9 "Тип приоритета прикладных научных исследований в интересах здравоохранения, которому соответствует продукт" указывается не менее одного и не более четырех типов приоритетов научных исследований в интересах здравоохранения, которым соответствует продукт, из справочника типов приоритетов научных исследований в интересах здравоохранения государственной информационной системы.
Сведения подпункта 9.1 пункта 9 не включаются в случае отсутствия в справочнике типов приоритетов научных исследований в интересах здравоохранения типа приоритета, которому соответствует продукт;
13) в подпункте 9.2 пункта 9 "Приоритет прикладных научных исследований в интересах здравоохранения, которому соответствует продукт" указывается не менее одного и не более двух приоритетов научных исследований в интересах здравоохранения, которому соответствует продукт, из справочника приоритетов научных исследований в интересах здравоохранения государственной информационной системы;
14) в пункте 10 "Обоснование соответствия продукта заявленному типу приоритета прикладных научных исследований в интересах здравоохранения" в краткой свободной форме приводится обоснование соответствия продукта типу приоритета (типам приоритетов) прикладных научных исследований в интересах здравоохранения, указанных в подпункте 9.1 пункта 9 раздела II формы направления отраслевых сведений.
Сведения пункта 10 не включаются в случае отсутствия в справочнике типов приоритетов научных исследований в интересах здравоохранения типа приоритета, которому соответствует продукт;
15) в подпункте 10.1 пункта 10 "Обоснование соответствия продукта заявленному приоритету (приоритетам) прикладных научных исследований в интересах здравоохранения" в краткой свободной форме приводится обоснование соответствия конечного результата приоритету (приоритетам) прикладных научных исследований в интересах здравоохранения, указанных в подпункте 9.2 пункта 9 формы направления отраслевых сведений.
Сведения подпункта 10.1 пункта 10 не включаются в случае указания в подпункте 9.2 пункта 9 формы направления отраслевых сведений приоритета научных исследований в интересах здравоохранения - "Иное";
16) в пункте 11 "Характеристика целевой группы пациентов, для которых предназначен продукт" приводится описание целевой группы пациентов с их ключевыми характеристиками, у которых предполагается применение лекарственного препарата или медицинского изделия, метода профилактики, диагностики, лечения или реабилитации, на разработку которого направлена тематика (работа), или в случае если тематика (работа) направлена на создание модели заболевания или выявление мишени для терапии заболевания, указывается такое заболевание.
Сведения пункта 11 не включаются для ожидаемых результатов, отнесенных к типам продуктов "Научные исследования в целях обеспечения экспертной деятельности", "Научные исследования в интересах организации здравоохранения и общественного здоровья" и "Иное". Для ожидаемых результатов, отнесенных к типу продукта "Выводы (рекомендации) для принятия управленческих решений на основании популяционных данных, эпидемиологических данных", внесение сведений пункта 11 осуществляется в случае если разрабатываемые выводы (рекомендации) непосредственно связаны с отдельными заболеваниями (состояниями);
17) в подпункте 11.1 пункта 11 "Численность целевой группы пациентов, для которых предназначен продукт (человек в год)" приводится количество человек в Российской Федерации в год, в интересах которых может применяться продукт. Для ожидаемых результатов, отнесенных к типам продуктов "Модель заболевания" и "Мишень для терапии", вносятся данные о количестве человек в Российской Федерации в год с заболеванием, для которого разрабатывается модель или осуществляется выявление мишени для терапии.
В случае если сведения пункта 11 не включаются, сведения подпункта 11.1 пункта 11 также не включаются;
18) в пункте 12 "Значимость продукта (влияние продукта на целевую группу пациентов, для которых предназначен продукт)" указываются прогнозируемые количественные эффекты от применения продукта в Российской Федерации в годовом исчислении. Для каждого вида ожидаемого эффекта в соответствии с подпунктами 12.1.1, 12.2.1, 12.3.1 и 12.4.1 пункта 12 раздела II формы направления отраслевых сведений указывается величина соответствующего ожидаемого эффекта в год посредством выбора одного из возможных значений (диапазона значений) ожидаемого эффекта в указанных для ожидаемого эффекта единицах измерения.
В случае выбора величины ожидаемого эффекта, отличного от нулевого, для соответствующего ожидаемого эффекта в подпунктах 12.1.2, 12.2.2, 12.2.3 и 12.2.4 пункта 12 раздела II формы направления отраслевых сведений "Обоснование ожидаемого эффекта" вносятся сведения, обосновывающие указанную величину ожидаемого эффекта.
Сведения пункта 12 не включаются для ожидаемых результатов, отнесенных к типам продуктов "Научные исследования в целях обеспечения экспертной деятельности", "Научные исследования в интересах организации здравоохранения и общественного здоровья", "Выводы (рекомендации) для принятия управленческих решений на основании популяционных данных, эпидемиологических данных", "Модель заболевания", "Мишень для терапии" и "Иное";
19) в пункте 13 "Сведения об аналогичных зарубежных разработках" в краткой свободной форме описываются существующие применяемые на практике или находящиеся в высокой степени готовности зарубежные аналоги продукта с указанием их производителя или разработчика, стадии разработки и ключевых характеристик с указанием источников информации, или указывается на отсутствие аналогичных зарубежных разработок.
Сведения пункта 13 не включаются для ожидаемых результатов, отнесенных к типам продуктов "Научные исследования в целях обеспечения экспертной деятельности", "Научные исследования в интересах организации здравоохранения и общественного здоровья", "Выводы (рекомендации) для принятия управленческих решений на основании популяционных данных, эпидемиологических данных", "Модель заболевания", "Мишень для терапии" и "Иное";
20) в пункте 14 "Сведения об аналогичных отечественных разработках" в краткой свободной форме описываются существующие применяемые на практике или находящиеся в высокой степени готовности российские аналоги продукта с указанием их производителя или разработчика, стадии разработки и ключевых характеристик с указанием источников информации, или указывается на отсутствие аналогичных российских разработок.
Сведения пункта 14 не включаются для ожидаемых результатов, отнесенных к типам продуктов "Научные исследования в целях обеспечения экспертной деятельности", "Научные исследования в интересах организации здравоохранения и общественного здоровья", "Выводы (рекомендации) для принятия управленческих решений на основании популяционных данных, эпидемиологических данных", "Модель заболевания", "Мишень для терапии" и "Иное";
21) в пункте 15 "Новизна продукта и его отличия от российских и зарубежных аналогов (в случае наличия таких аналогов)" в краткой свободной форме описывается новизна продукта и его ключевые отличия от российских и зарубежных аналогов в случае наличия таких аналогов, а также конкурентные преимущества продукта.
Сведения пункта 15 не включаются для ожидаемых результатов, отнесенных к типам продуктов "Научные исследования в целях обеспечения экспертной деятельности", "Научные исследования в интересах организации здравоохранения и общественного здоровья", "Выводы (рекомендации) для принятия управленческих решений на основании популяционных данных, эпидемиологических данных", "Модель заболевания", "Мишень для терапии" и "Иное";
22) в подпункте 15.1 пункта 15 "Наличие российских аналогов" осуществляется выбор ответа на вопрос о наличии или об отсутствии российских аналогов продукта.
Сведения подпункта 15.1 пункта 15 не включаются для ожидаемых результатов, отнесенных к типам продуктов "Научные исследования в целях обеспечения экспертной деятельности", "Научные исследования в интересах организации здравоохранения и общественного здоровья", "Выводы (рекомендации) для принятия управленческих решений на основании популяционных данных, эпидемиологических данных", "Модель заболевания", "Мишень для терапии" и "Иное";
23) в подпункте 15.2 пункта 15 "Наличие зарубежных аналогов" осуществляется выбор ответа на вопрос о наличии или об отсутствии зарубежных аналогов продукта.
Сведения подпункта 15.2 пункта 15 не включаются для ожидаемых результатов, отнесенных к типам продуктов "Научные исследования в целях обеспечения экспертной деятельности", "Научные исследования в интересах организации здравоохранения и общественного здоровья", "Выводы (рекомендации) для принятия управленческих решений на основании популяционных данных, эпидемиологических данных", "Модель заболевания", "Мишень для терапии" и "Иное";
24) в подпункте 15.3 пункта 15 "Сравнение с аналогами" в случае наличия аналогов в соответствии со сведениями, внесенными в подпунктах 15.1 и (или) 15.2 пункта 15 раздела II формы направления отраслевых сведений, осуществляется выбор ответа на вопрос о сравнительных характеристиках продукта с ними (уступает, превосходит или сопоставим с российскими и (или) зарубежными аналогами), а также осуществляется выбор ответа на вопросы о наличии или об отсутствии зарубежных аналогов продукта;
25) в подпункте 15.4 пункта 15 "Оценка новизны ожидаемого результата (баллов)" сведения в виде численного значения новизны ожидаемого результата в баллах от 0 до 12 баллов вносятся системой автоматически на основании сведений, внесенных в подпунктах 15.1, 15.2 и 15.3 пункта 15 раздела II формы направления отраслевых сведений, в соответствии со следующими критериями:
12 баллов - в случае отсутствия российских и зарубежных аналогов продукта;
10 баллов - в случае наличия российских и зарубежных аналогов продукта, при этом продукт превосходит российские и зарубежные аналоги;
9 баллов - в случае отсутствия российских аналогов и наличия зарубежных аналогов продукта, при этом продукт превосходит зарубежные аналоги;
8 баллов - в случае наличия российских и зарубежных аналогов продукта, при этом продукт превосходит российские аналоги и сопоставим с зарубежными аналогами;
7 баллов - в случае отсутствия российских аналогов и наличия зарубежных аналогов продукта, при этом продукт сопоставим с зарубежными аналогами;
6 баллов - в случае наличия российских и зарубежных аналогов продукта, при этом продукт превосходит российские аналоги, но уступает зарубежным аналогам;
5 баллов - в случае наличия российских аналогов и отсутствия зарубежных аналогов продукта, при этом продукт превосходит российские аналоги;
4 балла - в случае отсутствия российских аналогов и наличия зарубежных аналогов продукта, при этом продукт уступает зарубежным аналогам, или в случае наличия российских и зарубежных аналогов продукта, при этом продукт сопоставим с российскими аналогами и превосходит зарубежные аналоги;
3 балла - в случае наличия российских и зарубежных аналогов продукта, при этом продукт сопоставим с российскими аналогами и сопоставим с зарубежными аналогами;
2 балла - в случае наличия российских и зарубежных аналогов, при этом продукт сопоставим с российскими аналогами, но уступает зарубежным аналогам;
1 балл - в случае наличия российских аналогов и отсутствия зарубежных аналогов продукта, при этом продукт сопоставим с российскими аналогами;
0 баллов - в случае наличия российских аналогов, при этом продукт уступает российским аналогам, а также уступает зарубежным аналогам в случае их наличия;
26) в пункте 16 "Риски недостижения ожидаемого результата" в краткой свободной форме описываются риски недостижения ожидаемого результата, а также меры, которые позволят минимизировать указанные риски;
27) в пункте 17 "Сведения о предполагаемом производстве продукта и индустриальных партнерах" указываются сведения о производственных мощностях, на которых может быть размещено производство продукта, с указанием наличия договоренностей и их характера о готовности осуществлять технологический трансфер и выпуск продукта, а также сведения о заинтересованных в производстве продукта индустриальных партнерах с кратким описанием условий, при которых эта заинтересованность может быть реализована.
Сведения пункта 17 не включаются для продуктов, не являющихся лекарственными препаратами или медицинскими изделиями;
28) в пункте 18 "Сведения о потенциальных потребителях продукта" указываются сведения о производителях медицинской продукции, медицинских организациях, органах управления здравоохранением, иных субъектах, потенциально заинтересованных в использовании продукта;
29) в пункте 19 "Презентационные материалы, фото- и видеоматериалы о результате, на получение которого направлен (направлена) проект тематики (работа)" прикрепляются файлы, содержащие презентационные материалы, фото- и видеоматериалы об ожидаемом результате и (или) продукте (при наличии);
30) в пункте 20 "Иная дополнительная информация о результате, на получение которого направлен (направлена) проект тематики (работа)" в краткой свободной форме приводится иная дополнительная информация об ожидаемом результате и (или) продукте, значимая для наиболее полного описания ожидаемого результата и (или) продукта, внесение которой не предусмотрено иными пунктами формы направления отраслевых сведений (при наличии).
- Гражданский кодекс (ГК РФ)
- Жилищный кодекс (ЖК РФ)
- Налоговый кодекс (НК РФ)
- Трудовой кодекс (ТК РФ)
- Уголовный кодекс (УК РФ)
- Бюджетный кодекс (БК РФ)
- Арбитражный процессуальный кодекс
- Конституция РФ
- Земельный кодекс (ЗК РФ)
- Лесной кодекс (ЛК РФ)
- Семейный кодекс (СК РФ)
- Уголовно-исполнительный кодекс
- Уголовно-процессуальный кодекс
- Производственный календарь на 2025 год
- МРОТ 2026
- ФЗ «О банкротстве»
- О защите прав потребителей (ЗОЗПП)
- Об исполнительном производстве
- О персональных данных
- О налогах на имущество физических лиц
- О средствах массовой информации
- Производственный календарь на 2026 год
- Федеральный закон "О полиции" N 3-ФЗ
- Расходы организации ПБУ 10/99
- Минимальный размер оплаты труда (МРОТ)
- Календарь бухгалтера на 2025 год
- Частичная мобилизация: обзор новостей
- Постановление Правительства РФ N 1875
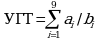 , где
, где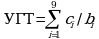 , где
, где