|
Клетки
|
Клеточная линия H295R (на основе клеточной линии адренокарциномы человека)
|
|
Назначение и ограничения
|
Метод предназначен для идентификации ксенобиотиков, мишенями которых являются эндогенные компоненты внутриклеточных биохимических путей, обеспечивающих синтез E2 и (или) T из холестерина. Метод позволяет обнаружить как увеличение, так и уменьшение продукции T и E2; проводить прямую оценку возможного воздействия вещества на жизнеспособность (цитотоксичность) клетки.
Метод не предназначен для идентификации веществ, влияющих на стероидогенез посредством воздействия на механизмы "гипоталамо-гипофизарно-гонадной" оси. Исследование не предназначено для получения информации относительно механизмов взаимодействия тестируемого вещества с эндокринной системой.
Принципиальными ограничениями метода являются:
- его метаболические способности неизвестны, но вероятно довольно ограничены; поэтому, вещества, которые должны быть метаболически активированы, вероятно, не будут выявлены в этом исследовании;
- будучи полученными из ткани надпочечников, клетки H295R обладают ферментами, способными к производству глюко- и минерало-кортикоидов, так же, как и половых гормонов; поэтому изменение уровня глюко- и минерало-кортикоидов может повлиять на уровни T и E2, наблюдаемые в исследовании;
- не выявляет наличие дигидротестостерона, поэтому не ожидается, что он обнаружит вещества, которые ингибируют 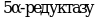 , в данном случае следует использовать тест Хершбергера , в данном случае следует использовать тест Хершбергера
|
|
Цель
|
Получение качественного ДА (НЕТ) ответа относительно способности вещества индуцировать или ингибировать продукцию E2 и T
|
|
Принцип метода
|
Метод позволяет обнаружить вещества, которые, ингибируют или индуцируют ферменты системы стероидогенеза. Пять ферментов катализируют шесть различных реакций, ответственных за биосинтез половых стероидных гормонов. Ферментативное преобразование холестерина в прегненолон осуществляется цитохромом P450 (CYP11A) и является начальным шагом в ряде биохимических реакций, которые завершаются образованием стероидных гормонов в качестве конечных продуктов. В зависимости от очередности двух следующих реакций стероидогенный путь биосинтеза подразделяется на два: 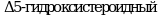 и и 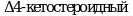 пути, которые завершаются образованием андростендиона. Андростендион преобразуется в тестостерон с помощью пути, которые завершаются образованием андростендиона. Андростендион преобразуется в тестостерон с помощью 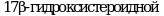 дегидрогеназы. Тестостерон одновременно является и промежуточным, и конечным гормональным продуктом. У мужчин тестостерон может быть преобразован в дигидротестостерон при помощи дегидрогеназы. Тестостерон одновременно является и промежуточным, и конечным гормональным продуктом. У мужчин тестостерон может быть преобразован в дигидротестостерон при помощи 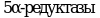 , которая найдена в клеточной и ядерной мембранах, а также в эндоплазматическом ретикулуме органов-мишеней действия андрогенных гормонов, таких как простата и семенные пузырьки. Дигидротестостерон является мощным андрогеном, чем тестостерон, и он также считается конечным гормоном. Метод не измеряет дигидротестостерон. Ароматаза (CYP19) преобразовывает андрогены в эстрогены - тестостерон в , которая найдена в клеточной и ядерной мембранах, а также в эндоплазматическом ретикулуме органов-мишеней действия андрогенных гормонов, таких как простата и семенные пузырьки. Дигидротестостерон является мощным андрогеном, чем тестостерон, и он также считается конечным гормоном. Метод не измеряет дигидротестостерон. Ароматаза (CYP19) преобразовывает андрогены в эстрогены - тестостерон в 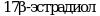 и андростендион в эстрон. Конечными продуктами стероидогенеза являются и андростендион в эстрон. Конечными продуктами стероидогенеза являются 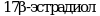 и тестостерон. и тестостерон.
Анализ обычно выполняют на 24-луночных планшетах при стандартных условиях культивирования клеток. После 24-часовой акклиматизации на многолуночном планшете клетки подвергают 48-часовой экспозиции с веществом в семи различных концентрациях, в трех повторностях каждая
|
|
Интерпретация результатов
|
Данные отображают в виде кратности изменения относительно контроля растворителя и в виде минимальной концентрации наблюдаемого эффекта. Если результат исследования полностью отрицательный, наивысшая использовавшаяся концентрация фиксируется как концентрация отсутствия эффекта
|
|
Описание метода
|
После инициирования клеточной культуры H295R клетки должны пройти пять пассажей (т.е. клетки должны пересеваться 4 раза). Клетки пятого пассажа замораживают в жидком азоте для хранения. До замораживания клеток, образец клеток предыдущего, 4 пассажа, тестируют на контрольном планшете, чтобы убедиться, что базовый уровень продуцируемых гормонов и ответ на вещества положительного контроля соответствует критериям контроля качества.
Каждая лаборатория для анализа продукции T и E2 клетками H295R использует систему измерения гормонов по своему выбору, если он соответствует критериям, включая предельно определяемое количество. Номинально предельно определяемое количество составляет 100 пг/мл для T и 10 пг/мл для E2, эти значения основаны на базальном уровне продукции гормонов, наблюдаемых в исследованиях по валидизации.
Проверку уровня квалификации проводят при экспозиции клеток в семи увеличивающихся концентрациях сильных, умеренных и слабых индукторов и ингибиторов, а также нейтральных веществ (6 референсных веществ)
|
|
Анализ и интерпретация данных
|
В ходе лабораторной проверки уровня квалификации проводят экспозицию клеток H295R на 24-луночных планшетах с контрольными веществами. Концентрации указаны в мкМ для всех проверяемых доз. Вещества добавляют в виде раствора в ДМСО, вносимое количество ДМСО одинаково для всех лунок и составляет 0,1% об. Все используемые концентрации проверяют троекратно, т.е. одновременно в трех лунках. Для каждого вещества используют отдельный планшет. Один планшет используют для каждого из выполняемых за день тестов.
Пороговое значение LOEC и решение по классификации проверочного вещества представляют в отчете в сравнении с эталонными веществами.
Для оценки относительного увеличения (уменьшения) продукции гормонов под действием тестируемых веществ, результаты нормализуют относительно среднего значения для каждого тестового планшета и представляют как изменения гормона относительно стандартного отклонения для каждого тестового планшета. Все данные представляют как среднее значение  1 стандартного отклонения. 1 стандартного отклонения.
Вещество классифицируют как положительное, если кратность индукции статистически значимо (p 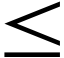 0,05) отличается от контроля растворителя для двух соседних концентраций, по крайней мере, в двух независимых раундах тестирования. Вещество классифицируют как отрицательное после двух независимых раундов тестирования с отрицательным эффектом или после трех независимых раундов, два из которых дали отрицательный результат, а один раунд оказался положительным или неоднозначным. Если данные, полученные в трех независимых экспериментах, не соответствуют критериям классификации, то результаты таких экспериментов считают не интерпретируемыми. Результаты для концентраций, превышающих пределы растворимости или имеющие цитотоксический эффект, не включают в анализ и интерпретацию результатов 0,05) отличается от контроля растворителя для двух соседних концентраций, по крайней мере, в двух независимых раундах тестирования. Вещество классифицируют как отрицательное после двух независимых раундов тестирования с отрицательным эффектом или после трех независимых раундов, два из которых дали отрицательный результат, а один раунд оказался положительным или неоднозначным. Если данные, полученные в трех независимых экспериментах, не соответствуют критериям классификации, то результаты таких экспериментов считают не интерпретируемыми. Результаты для концентраций, превышающих пределы растворимости или имеющие цитотоксический эффект, не включают в анализ и интерпретацию результатов
|
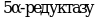 , в данном случае следует использовать тест Хершбергера
, в данном случае следует использовать тест Хершбергера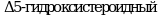 и
и 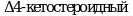 пути, которые завершаются образованием андростендиона. Андростендион преобразуется в тестостерон с помощью
пути, которые завершаются образованием андростендиона. Андростендион преобразуется в тестостерон с помощью 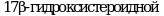 дегидрогеназы. Тестостерон одновременно является и промежуточным, и конечным гормональным продуктом. У мужчин тестостерон может быть преобразован в дигидротестостерон при помощи
дегидрогеназы. Тестостерон одновременно является и промежуточным, и конечным гормональным продуктом. У мужчин тестостерон может быть преобразован в дигидротестостерон при помощи 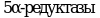 , которая найдена в клеточной и ядерной мембранах, а также в эндоплазматическом ретикулуме органов-мишеней действия андрогенных гормонов, таких как простата и семенные пузырьки. Дигидротестостерон является мощным андрогеном, чем тестостерон, и он также считается конечным гормоном. Метод не измеряет дигидротестостерон. Ароматаза (CYP19) преобразовывает андрогены в эстрогены - тестостерон в
, которая найдена в клеточной и ядерной мембранах, а также в эндоплазматическом ретикулуме органов-мишеней действия андрогенных гормонов, таких как простата и семенные пузырьки. Дигидротестостерон является мощным андрогеном, чем тестостерон, и он также считается конечным гормоном. Метод не измеряет дигидротестостерон. Ароматаза (CYP19) преобразовывает андрогены в эстрогены - тестостерон в 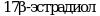 и андростендион в эстрон. Конечными продуктами стероидогенеза являются
и андростендион в эстрон. Конечными продуктами стероидогенеза являются 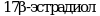 и тестостерон.
и тестостерон.