IV. Применение методики генотипирования и филогенетического анализа при проведении эпидемиологического расследования случаев ВИЧ-инфекции и вирусного гепатита C
IV. Применение методики генотипирования и филогенетического
анализа при проведении эпидемиологического расследования
случаев ВИЧ-инфекции и вирусного гепатита C
4.1. Генотипирование и филогенетический анализ нуклеотидных последовательностей используется в качестве дополнительного инструмента при проведении эпидемиологического расследования случаев ВИЧ-инфекции и ГC, предположительно связанных с оказанием медицинской помощи или других сложных (с эпидемиологической точки зрения) случаев <31>. Данные методы могут применяться при расследовании групповых случаев заражения ВИЧ-инфекцией и ГC (подозрения на них) <32>.
--------------------------------
<31> Пункты 615, 755 СанПиН 3.3686-21.
<32> Пункт 3540 главы XLIV СанПиН 3.3686-21.
4.2. Анализ степени генетической близости штаммов ВИЧ, ВГC и филогенетический анализ применяется с целью обеспечения дополнительной доказательной базы при определении связанности лиц - участников цепи передачи ВИЧ-инфекции.
4.3. Основными источниками, позволяющими сделать заключение о связанности лиц - участников цепи передачи инфекции, являются результаты эпидемиологического расследования и данные медицинской документации. Филогенетический анализ позволяет выявить наиболее вероятный источник инфекции при наличии нескольких вариантов. Результаты филогенетического анализа рассматриваются в комплексе с другими эпидемиологическими и клиническими данными. Филогенетический анализ не может предоставить единственные или окончательные доказательства пути, направления и времени передачи инфекции, но используется в контексте всех имеющихся эпидемиологических данных и доказательств.
Основные принципы филогенетического анализа нуклеотидных последовательностей, полученных от инфицированных ВИЧ и ВГC и варианты интерпретации его результатов приведены в приложении 2 к настоящим МР.
4.4. На исследование рекомендуется представить образцы крови от пациентов из исследуемой и контрольной групп. В исследуемую группу включаются пострадавший/пострадавшие и все лица, потенциально являющиеся для него/них источником инфекции. В группу сравнения (контрольная группа) включаются не менее 20 - 30 образцов крови, полученных от инфицированных из того же субъекта Российской Федерации, социальной группы, группы риска заражения и инфицированных в близкие (к исследуемой группе) сроки. Учитывается опыт получения антиретровирусной терапии (далее - АРТ) или противовирусной терапии у лиц из контрольной группы. В качестве образцов контрольной группы могут использоваться охарактеризованные нуклеотидные последовательности из открытых баз данных <33>, подобранные по аналогичным критериям.
--------------------------------
<33> Российская база данных устойчивости ВИЧ к антиретровирусным препаратам (далее - Российская база данных): ruhiv.ru (в свободном доступе) (далее - ruhiv.ru); базы данных генетических последовательностей ВИЧ (англ. HIV Databases): www.hiv.lanl.gov (в свободном доступе).
4.5. Для проведения генотипирования и филогенетического анализа организуется забор материала от больных ВИЧ-инфекцией или ГC, соблюдается порядок направления, регистрации и исследования образцов <34>.
--------------------------------
<34> Глава IV СанПиН 3.3686-21.
4.5.1. Для получения достоверных результатов генотипирования и филогенетического анализа исключаются ошибки на преаналитическом этапе исследования. На всех этапах лабораторной работы принимаются меры по исключению возможности контаминации и неправильной маркировки образцов. Учитывается наличие потенциально возможной заинтересованности у отдельных лиц в получении определенных результатов исследования.
4.5.2. Для определения связи между биологическими образцами от пациентов предположительно из одной эпидемиологической цепи (исследуемая группа), проводится забор образцов крови от всех инфицированных ВИЧ или ВГC из предполагаемого очага передачи инфекции, а также образцов крови от инфицированных лиц из группы сравнения. В исследуемую группу включаются пострадавшие и все лица, потенциально являющиеся для них источником инфекции. Забор образцов крови от пациентов, включенных в исследуемую группу и группу сравнения проводится сотрудниками МО, в которой вышеуказанные пациенты получают медицинскую помощь или состоят на диспансерном наблюдении. Для обеспечения достоверности результатов обследования рекомендуется организовать комиссию, состоящую из врачей и среднего медперсонала, для забора образцов крови от всех пациентов из исследуемой группы с оформлением направлений на исследование и сопроводительной документации. В состав комиссии могут входить специалисты Роспотребнадзора, врачи МО, в которой проводится забор образцов, и следственных органов, если проведение исследования инициировано ими.
При невозможности забора крови для генотипирования у какого-либо из потенциальных источников ВИЧ-инфекции (в связи с переездом в другой субъект Российской Федерации, отказом от обследования или смертью) рекомендуется рассмотреть возможность поиска и направления на исследование архивированных образцов сыворотки/плазмы крови от данных пациентов из банка первично позитивных в иммунном блоте образцов Центра СПИД. Возможен забор образцов крови от пациентов, достоверно связанных эпидемиологически с потенциальным источником инфекции, в том числе от родителей умерших инфицированных ВИЧ детей, зараженных перинатально, или супругов потенциальных источников инфекции, зараженных от них половым путем.
При расследовании групповых случаев гемоконтактных инфекций, предположительно ИСМП, нецелесообразно включать в контрольную группу пациентов той же МО, в которой предположительно произошла передача инфекции, поскольку они могут относиться к той же цепочке передачи инфекции.
4.5.3. На каждый образец заполняется направление на генотипирование ВИЧ (приложение 3 к настоящим МР) или направление на генотипирование ВГC (приложение 4 к настоящим МР). Направление заполняется с учетом доступности необходимой информации, указывается принадлежность образца к исследуемой или контрольной группе.
В целях получения корректных результатов генотипирования на исследование могут быть не приняты образцы, при отсутствии следующих сведений:
- дата 1-го выявления маркеров ВИЧ;
- получал ли пациент антиретровирусные препараты (далее - АРВ-препараты);
4.5.4. Для проведения генотипирования проводится забор венозной крови. Кровь забирается в специализированные вакуумные контейнеры (пробирки), содержащие в качестве консерванта этилендиаминтетрауксусную кислоту (далее - ЭДТА). Образцам для проведения генотипирования присваивается индивидуальный номер в соответствии с направительным бланком, данный номер наносится на пробирку с пробой после забора образца. Маркировка на пробирку с пробой наносится с использованием водостойкого фломастера черного или синего цвета, чтобы идентифицировать пробу с направительным бланком. Для повышения надежности результатов рекомендуется направить на исследование по два образца от пациентов из исследуемой группы, отобранных в разные сроки.
Для каждого пациента, включенного в исследуемую или контрольную группу, указывается уровень вирусной нагрузки. Если со времени последнего анализа прошло более 1 месяца, проводится исследование вирусной нагрузки образца, забранного для проведения генотипирования, до его транспортировки.
4.5.5. В зависимости от уровня вирусной нагрузки ВИЧ или ВГC у пациентов из исследуемой группы (инфицированные ВИЧ или ВГC из предполагаемого очага заболевания) и доступности биологических образцов производится выбор вида доставляемого материала. Субстратом для получения нуклеотидных последовательностей для филогенетического анализа является вирусная РНК (ВИЧ/ВГC) и провирусная ДНК (ВИЧ). В рамках проведения одного анализа используется только один тип субстрата для всех образцов как исследуемой группы, так и группы сравнения. Генотипирование образцов с использованием вирусной РНК от пациентов с неопределяемой вирусной нагрузкой, длительно получающих эффективную АРТ и противовирусную терапию, не проводится. В случае с ВИЧ-инфекцией, при неопределяемой вирусной нагрузке, в качестве субстрата выступает провирусная ДНК. Если вирусная нагрузка у всех образцов, относящихся к исследуемой группе, составляет более 1000 коп/мл, то для каждого пациента из обеих групп исследование проводится на матрице вирусной РНК с использованием плазмы крови; для каждого пациента из обеих групп на исследование направляется не менее 2 мл плазмы крови (если объем превышает 1,5 мл, направляется несколько аликвот по 0,5 - 1 мл). В случае если вирусная нагрузка ВИЧ у одного из пациентов исследуемой группы составляет менее 1000 коп/мл, то для всех пациентов этой группы анализ проводится на матрице провирусной ДНК с использованием лейкоцитов; для каждого пациента из обеих групп на исследование направляется пробирка 5 - 10 мл цельной крови с ЭДТА. Образцы доставляются в лабораторию в течение 48 ч с момента забора и транспортируются при температуре плюс 2 - 8 °C (хладагенты), но не менее 0 °C; при невозможности соблюдения указанных условий для каждого пациента на исследование направляются не менее 2 аликвот лейкоцитов плазмы крови.
Для забора лейкоцитов используется свежая цельная кровь (5 - 10 мл), забранная из вены пациента в одноразовую пробирку с ЭДТА. После забора крови пробирку нужно аккуратно перевернуть 3 - 4 раза и затем центрифугировать при 800 - 1600 g в течение 20 мин. Необходимо соблюдать рекомендуемую скорость центрифугирования, при более высоком количестве оборотов лейкоциты не останутся под плазмой в виде фракции, и забрать их будет невозможно. В 2 - 4 пробирки объемом 1,5 мл необходимо отобрать по 250 мкл лейкоцитарного кольца (находится на границе фаз плазмы и форменных элементов). Допустимо присутствие эритроцитов из нижележащего сгустка за лейкоцитарным кольцом.
Пробирки с плазмой крови и отобранными лейкоцитами маркируют в соответствии с индивидуальным номером пациента. Отобранные лейкоциты хранят при температуре не выше минус 18 °C (сухой лед, хладагенты).
В случае если образцы транспортируются в первичных пробирках (цельная кровь с ЭДТА), транспортировка осуществляется при температуре плюс 5 - 15 °C в течение 48 ч. Не допускается замораживание цельной крови.
Если вирусная нагрузка менее 1000 коп/мл обнаруживается у пациента, относящегося к группе сравнения, то такой образец исключается из проведения анализа.
4.5.6. Транспортировку образцов, сопроводительной документации и направительных бланков для проведения генотипирования осуществляет организация, инициирующая исследование. Упаковка и маркировка образцов осуществляется с учетом требований, предъявляемых к транспортировке патогенных биологических агентов (далее - ПБА) III - IV групп патогенности (опасности), классифицируемых как грузы 6-го класса опасности <35>.
--------------------------------
<35> Приложение 8 СанПиН 3.3686-21.
Образцы в присутствии членов комиссии упаковываются в полиэтиленовые пакеты с герметично закрывающейся полимерной зипперной лентой (застежкой типа "zip-lock"), образцы от пациентов исследуемой группы упаковываются в индивидуальные пакеты отдельно друг от друга и от образцов контрольной группы. Пакеты с образцами помещаются в специализированный транспортировочный термоконтейнер, совместно с аккумуляторами холода, охлажденными до температуры не выше минус 18 °C (по возможности аккумуляторы холода охлаждаются до температуры не выше минус 68 °C) или сухим льдом. В транспортный контейнер совместно с изолированным контейнером, содержащим образцы, прикладывается сопроводительная документация, включающая направления на генотипирование ВИЧ или на генотипирование ВГC. Транспортный контейнер опечатывается в присутствии членов комиссии.
4.5.7. В сопроводительной документации указывается адрес направляющей и принимающей организации, контактные телефоны, а также Ф.И.О. ответственных лиц. К запросу на генотипирование прикладываются предварительные результаты эпидемиологического расследования случаев ВИЧ-инфекции или ГC, копии карт эпидемиологического расследования по случаям инфекции у пациентов исследуемой группы, обосновывающие необходимость проведения высокотехнологичных исследований.
4.5.8. Доставка контейнера с образцами и сопроводительной документацией осуществляется сотрудником направляющей организации или представителем транспортной компании.
4.5.9. Сотрудник организации, уполномоченный принимать образцы на генотипирование, при получении контейнера и сопроводительной документации проверяет отсутствие признаков вскрытия контейнера с образцами, контролирует соответствие числа образцов количеству направлений и данным сопроводительной документации, сохранность и читаемость маркировки пробирок, соответствие идентификационных номеров на пробирках и в сопроводительной документации.
В срок не более 2 ч с момента доставки образцов контейнер вскрывается, проверяется, находятся ли образцы в замороженном состоянии. В случае приемки образцов в первичных пробирках они проверяются на отсутствие признаков гемолиза и отсутствие сгустков. В случае приемки образцов в первичных пробирках образцы предварительно аликвотируются. После проверки образцы помещаются на хранение при температуре не выше минус 18 °C. Сотрудник организации, принимающей на генотипирование образцы, составляет и подписывает акт приемки образцов, где указываются дата приемки, количество поступивших образцов с кратким описанием внешнего вида и выявленных недочетов. Все поступившие на генотипирование образцы регистрируются сотрудниками организации, принимающей пробы на генотипирование, в журнале регистрации патогенных биологических агентов, объектов (проб, образцов), поступивших для исследования методом генотипирования и филогенетического анализа при проведении эпидемиологического расследования случаев ВИЧ и ГC (приложение 5 к настоящим МР).
4.6. Рекомендуется следующий порядок применения методики генотипирования ВИЧ и филогенетического анализа при проведении эпидемиологического расследования случаев ВИЧ-инфекции:
4.6.1. Для получения нуклеотидных последовательностей используются методы популяционного секвенирования (секвенирование по методу Сэнгера) и массового параллельного секвенирования с предварительным специфическим обогащением (например, полимеразная цепная реакция (далее - ПЦР) или без него. Для обеспечения большей стандартизации рекомендуется использование зарегистрированных и разрешенных к применению на территории Российской Федерации в установленном порядке <36> наборов реагентов, предназначенных для определения лекарственной устойчивости ВИЧ, если они позволяют получить нуклеотидные последовательности в необходимом для анализа объеме. По каждому образцу необходимо получить нуклеотидные последовательности длиной не менее 1000 пар нуклеотидов для консервативных участков генома (например, ген pol) и не менее 300 пар нуклеотидов для вариабельных участков (например, ген env) генома ВИЧ. Рекомендуется использовать гены с различными функциями и различной скоростью эволюции (env, pol, pro/rev, int).
--------------------------------
<36> Часть 4 статьи 38 Федерального закона от 21.11.2011 N 323-ФЗ "Об основах охраны здоровья граждан в Российской Федерации" (далее - Федеральный закон от 21.11.2011 N 323-ФЗ); постановление Правительства Российской Федерации от 27.12.2012 N 1416 "Об утверждении Правил государственной регистрации медицинских изделий" (далее - постановление Правительства Российской Федерации от 27.12.2012 N 1416).
В случае использования гена pol для анализа образцов от пациентов, получающих АРТ, одинаковые схемы терапии могут привести к появлению аналогичных мутаций, что может уменьшить генетическую дистанцию даже при отсутствии эпидемиологической связи между образцами. Для снижения риска получения недостоверных результатов из анализа исключаются позиции лекарственной устойчивости или пациенты, получающих АРТ.
4.6.2. Для получения нуклеотидных последовательностей при использовании популяционного секвенирования рекомендуется обеспечить покрытие большей части секвенируемого участка генома как минимум двумя хроматограммами.
При формировании консенсусной последовательности в случае наличия полиморфной позиции (одновременное присутствие двух или более пиков хроматограмм в одной позиции) рекомендуется придерживаться следующих правил интерпретации:
- если на одной из хроматограмм присутствует один четкий пик, а на другой, наряду с четким пиком, присутствует сильный подпик (высота больше 1/3 высоты основного пика), то в консенсусной последовательности оставляют полиморфизм;
- если на одной из хроматограмм присутствует один четкий пик, а на другой, наряду с четким пиком, присутствует слабый подпик (высота меньше или равна 1/3 высоты основного пика), то в консенсусной последовательности вместо полиморфизма поставьте нуклеотид, соответствующий четкому пику;
- если в двух хроматограммах для позиции наряду с четкими пиками присутствуют одинаковые подпики, оставьте в данной позиции полиморфизм;
- если на одной из хроматограмм наряду с четким пиком присутствует слабый подпик, а на другой хроматограмме, наряду с четким пиком, присутствует сильный подпик, то в консенсусной последовательности оставьте полиморфизм согласно второй хроматограмме;
- если на одной из хроматограмм в анализируемой позиции присутствует несколько слабовыраженных пиков одновременно, а на другой хроматограмме четкий пик, то в консенсусной последовательности вместо полиморфизма поставьте нуклеотид, соответствующий четкому пику;
- если на одной из хроматограмм присутствует эффект смещения (соседние пики накладываются друг на друга), то в консенсусной последовательности вместо полиморфизма поставьте нуклеотиды, присутствующие на второй хроматограмме;
- если для участка получена только одна хроматограмма, в анализируемой позиции которой наряду с четким пиком присутствует сильный подпик, то в консенсусной последовательности оставьте полиморфизм;
- если для участка получена только одна хроматограмма, в анализируемой позиции которой наряду с четким пиком присутствует слабый подпик, то в консенсусной последовательности вместо вырождения поставьте нуклеотид, соответствующий четкому пику.
4.6.3. При использовании для получения нуклеотидных последовательностей ВИЧ массового параллельного секвенирования уровень чувствительности к минорной вирусной популяции составляет 15 - 20%.
4.6.4. Полученные последовательности заносят в базу данных, а затем объединяют в единый файл формата .fasta. При создании единого файла в качестве названий последовательности рекомендуется указывать идентификационный номер пациента. После того, как были получены последовательности от образцов исследуемой группы и группы сравнения, подобранной в субъекте Российской Федерации, группа сравнения дополняется 5 - 15 последовательностями наиболее близкими к последовательностям исследуемой группы. Для подбора таких последовательностей можно воспользоваться ресурсом BLAST <37>. Кроме того, группа сравнения дополняется 5 - 15 и более последовательностями, ранее полученными от пациентов из субъекта Российской Федерации, хранящихся в региональной или Российской базе данных <38>. Для подбора последовательностей из Российской базы данных рекомендуется обратиться во ФБУН "Центральный научно-исследовательский институт эпидемиологии" Роспотребнадзора. Все последовательности, подобранные в базах данных, также вносятся в единый файл формата .fasta.
--------------------------------
<37> Программа для поиска сходных аминокислотных и нуклеотидных последовательностей: blast.ncbi.nlm.nih.gov/Blast.cgi?PROGRAM=blastn&PAGE_TYPE=BlastSearch&LINK_LOC=blasthome (в свободном доступе) (далее - blast.ncbi.nlm.nih.gov/Blast.cgi?PROGRAM=blastn&PAGE_TYPE=BlastSearch&LINK_LOC=blasthome).
Примечание: для подбора нуклеотидных последовательностей допускается использовать программы с аналогичными или лучшими характеристиками.
4.6.5. Обработка нуклеотидных последовательностей. После объединения всех подобранных последовательностей они выравниваются друг относительно друга. Для этого рекомендуется использовать специализированное программное обеспечение (далее - ПО) (например, BioEdit, Geneious, Ugene) <39> или воспользоваться ресурсами, доступными в информационно-телекоммуникационной сети "Интернет" (далее - сеть "Интернет") (например, HIVAlign <40>, MUSCLE <41>). После проведения выравнивания все нуклеотидные последовательности обрезают по краям для приведения их к одинаковой длине. Приоритет отдается последовательностям от пациентов, включенных в исследуемую группу. Если протяженность полученной нуклеотидной последовательности от образца из группы сравнения значительно меньше таковой у других образцов, в особенности из исследуемой группы, то такой образец исключается из анализа. Если протяженность последовательностей от образцов исследуемой группы составила менее рекомендуемых 1000 пар нуклеотидов для консервативных участков генома и 300 пар нуклеотидов для вариабельных участков, рекомендуется повторное проведение анализа для данных образцов, начиная с этапа экстракции.
--------------------------------
<39> Примечание: для выравнивания нуклеотидных последовательностей допускается использовать программное обеспечение с аналогичными или лучшими характеристиками.
<40> Программа для выравнивания нуклеотидных последовательностей (англ. HIVAlign): hiv.lanl.gov/content/sequence/VIRALIGN/viralign.html (в свободном доступе) (далее - hiv.lanl.gov/content/sequence/VIRALIGN/viralign.html).
<41> Программа для выравнивания множественных аминокислотных и нуклеотидных последовательностей (англ. multiple sequence alignment method with reduced time and space complexity, MUSCLE): ebi.ac.uk/Tools/msa/muscle (в свободном доступе) (далее - ebi.ac.uk/Tools/msa/muscle).
4.6.6. Анализ нуклеотидных последовательностей. На первом этапе анализа для каждого образца, включенного в исследование, определяется субтип. Для определения субтипа можно воспользоваться специализированными ресурсами в сети "Интернет" (например, REGA HIV-1 Subtyping Tool <42>, COMET <43>) <44>. Полученные результаты определения субтипов для каждого образца вносятся в базу данных исследования. Образцы группы сравнения, субтип которых отличается от субтипа образцов исследуемой группы, исключаются из дальнейшего анализа.
--------------------------------
<42> Инструмент по определению субтипа нуклеотидной последовательности (англ. REGA HIV-1 Subtyping Tool): dbpartners.stanford.edu:8080/RegaSubtyping/stanford-hiv/typingtool (в свободной доступе).
<43> Инструмент по классификации нуклеотидных последовательностей по субтипам (англ. COntext-based Modeling for Expeditious Typing, COMET): comet.lih.lu (в свободном доступе) (далее - comet.lih.lu).
<44> Примечание: для определения субтипа нуклеотидной последовательности допускается использовать инструменты с аналогичными или лучшими характеристиками.
Филогенетический анализ полученных последовательностей проводится с использованием специализированного биоинформатического ПО (например, MEGA <45>). При проведении анализа рекомендуется рассчитать парные генетические дистанции для всех образцов, участвующих в исследовании, и построить филогенетическое дерево (дендрограмму). Для построения филогенетического дерева рекомендуется использовать наиболее достоверную биоинформатическую модель (например, General Time Reversible model в сочетании с использованием гамма-распределенных инвариантных позиций). Проверка филогении осуществляется методом статистического бутстрэпа с количеством повторов не менее 500.
--------------------------------
<45> Программное обеспечение для проведения филогенетического анализа (англ. Molecular Evolutionary Genetics Analysis, MEGA): megasoftware.net (в свободном доступе) (далее - megasoftware.net). Примечание: для проведения филогенетического анализа нуклеотидных последовательностей допускается применять ПО с аналогичными или лучшими характеристиками.
4.6.7. При проведении генотипирования и филогенетического анализа заполняется электронная таблица, содержащая сведения:
- идентификационный номер пациента;
- Ф.И.О. пациента (при наличии);
- относится ли данный образец к исследуемой или контрольной группе;
- субъект Российской Федерации, адрес по регистрации, адрес фактического проживания;
- дата первого выявления маркеров ВИЧ (ИБ-позитивный или выявлены РНК/ДНК ВИЧ);
- получал ли пациент АРВ-препараты;
- показатель последнего исследования на вирусную нагрузку (копий/мл);
- дата последнего исследования на вирусную нагрузку;
- последний результат исследования на CD4+ T-клетки (клеток/мм3);
- дата последнего исследования на CD4+ T-клетки;
- Ф.И.О. специалиста, проводившего исследование.
4.7. Рекомендуется следующий порядок применения методики генотипирования ВГC и филогенетического анализа при проведении эпидемиологического расследования случаев ГC:
4.7.1. Получение нуклеотидных последовательностей ВГC. Для получения нуклеотидных последовательностей рекомендуется использовать как методы популяционного секвенирования (секвенирование по методу Сэнгера), так и массового параллельного секвенирования с предварительным специфическим обогащением (например, ПЦР) или без него. Рекомендуется использование зарегистрированных и разрешенных к применению на территории Российской Федерации в установленном порядке <46> наборов реагентов, предназначенных для определения лекарственной устойчивости ВГC, в том случае, если они позволяют получить нуклеотидные последовательности в необходимом для анализа объеме. Для каждого образца требуется получить нуклеотидные последовательности общей протяженностью не менее 1000 пар нуклеотидов. Рекомендуется использовать гены с различными функциями и различной скоростью эволюции (например, Core, NS3, NS5A, NS5B).
--------------------------------
<46> Часть 4 статьи 38 Федерального закона от 21.11.2011 N 323-ФЗ; постановление Правительства Российской Федерации от 27.12.2012 N 1416.
4.7.2. Для получения нуклеотидных последовательностей при использовании популяционного секвенирования рекомендуется обеспечить покрытие большей части секвенируемого участка генома как минимум двумя хроматограммами. При формировании консенсусной последовательности в случае наличия полиморфной позиции (одновременное присутствие двух или более пиков хроматограмм в одной позиции) рекомендуется придерживаться следующих правил интерпретации:
- если на одной из хроматограмм присутствует один четкий пик, а на другой, наряду с четким пиком, присутствует сильный подпик (высота больше 1/3 высоты основного пика), то в консенсусной последовательности необходимо поставить полиморфизм;
- если на одной из хроматограмм присутствует один четкий пик, а на другой, наряду с четким пиком, присутствует слабый подпик (высота меньше или равна 1/3 высоты основного пика), то в консенсусной последовательности вместо полиморфизма необходимо поставить нуклеотид, соответствующий четкому пику;
- если в двух хроматограммах для позиции, наряду с четкими пиками, присутствуют одинаковые подпики, необходимо поставить в данной позиции полиморфизм;
- если на одной из хроматограмм, наряду с четким пиком, присутствует слабый подпик, а на другой хроматограмме, наряду с четким пиком, присутствует сильный подпик, то в консенсусной последовательности необходимо поставить полиморфизм согласно второй хроматограмме;
- если на одной из хроматограмм в анализируемой позиции присутствует несколько слабовыраженных пиков одновременно, а на другой хроматограмме четкий пик, то в консенсусной последовательности вместо полиморфизма необходимо поставить нуклеотид, соответствующий четкому пику;
- если на одной из хроматограмм присутствует эффект смещения (соседние пики накладываются друг на друга), то в консенсусной последовательности вместо полиморфизма необходимо поставить нуклеотиды, присутствующие на второй хроматограмме;
- если для участка получена только одна хроматограмма, в анализируемой позиции которой, наряду с четким пиком, присутствует сильный подпик, то в консенсусной последовательности необходимо поставить полиморфизм;
- если для участка получена только одна хроматограмма, в анализируемой позиции которой, наряду с четким пиком, присутствует слабый подпик, то в консенсусной последовательности вместо вырождения необходимо поставить нуклеотид, соответствующий четкому пику.
4.7.3. При использовании для получения нуклеотидных последовательностей массового параллельного секвенирования уровень чувствительности к минорной вирусной популяции составляет 15 - 20%.
4.7.4. Полученные последовательности рекомендуется занести в базу данных, а затем объединить в единый файл формата .fasta. При создании единого файла в качестве названий последовательности рекомендуется указывать идентификационный номер пациента. После того, как были получены последовательности от образцов исследуемой группы и группы сравнения, подобранной в субъекте Российской Федерации проведения расследования, группа сравнения дополняется 5 - 15 последовательностями, близкими к последовательностям исследуемой группы, депонированными в открытые базы данных. Для подбора таких последовательностей можно воспользоваться ресурсом BLAST <47>. Также группа сравнения дополняется 5 - 15 ранее полученными последовательностями от пациентов из субъекта Российской Федерации, а при их наличии, во внутренней базе данных учреждения, выполняющего анализ. Все последовательности, подобранные в базах данных, вносятся в единый файл формата .fasta.
--------------------------------
<47> blast.ncbi.nlm.nih.gov/Blast.cgi?PROGRAM=blastn&PAGE_TYPE=BlastSearch&LINK_LOC=blasthome.
4.7.5. Обработка нуклеотидных последовательностей. После объединения всех подобранных генетических последовательностей в одном файле они выравниваются друг относительно друга. Для этого рекомендуется использовать специализированное ПО (например, BioEdit, Geneious, Ugene) <48> или воспользоваться ресурсами, доступными в сети "Интернет" (например, HIVAlign <49>, MUSCLE <50>). После проведения выравнивания все нуклеотидные последовательности обрезают по краям для приведения их к одинаковой длине. Приоритет отдается последовательностям от пациентов, включенных в исследуемую группу. Если протяженность полученной нуклеотидной последовательности от образца из группы сравнения значительно меньше таковой у других образцов, в особенности из исследуемой группы, то такой образец исключается из анализа. В случае если суммарная протяженность последовательностей составила менее рекомендуемых 1000 пар нуклеотидов для образца из исследуемой группы, то для данного образца рекомендуется повторное проведение анализа, начиная с этапа экстракции.
--------------------------------
<48> Примечание: для выравнивания нуклеотидных последовательностей допускается использовать программное обеспечение с аналогичными или лучшими характеристиками.
<49> hiv.lanl.gov/content/sequence/VIRALIGN/viralign.html.
<50> ebi.ac.uk/Tools/msa/muscle.
4.7.6. Анализ нуклеотидных последовательностей. На первом этапе анализа, для каждого образца, включенного в исследование, рекомендуется определить его генотип. Для определения генотипа используются специализированные тест-системы или специализированный ресурс в сети "Интернет" (например, COMET <51>) <52>.
--------------------------------
<52> Примечание: для определения субтипа нуклеотидной последовательности допускается использовать инструменты с аналогичными или лучшими характеристиками.
Секвенирование ВГC может производиться специализированным набором реагентов, зарегистрированным и разрешенным к применению на территории Российской Федерации в установленном порядке <53>. Согласно результатам, полученным методом генотипирования, рекомендуется выбирать один из трех регионов для секвенирования. Аналитическая чувствительность для регионов: NS3 - 500 МЕ/мл; NS5A - 2000 МЕ/мл; NS5B - 5000 МЕ/мл. Образцы с концентрацией ниже порогового уровня тест-системы не исследуются.
--------------------------------
<53> Часть 4 статьи 38 Федерального закона от 21.11.2011 N 323-ФЗ; постановление Правительства Российской Федерации от 27.12.2012 N 1416.
Полученные результаты генотипирования для каждого образца вносятся в базу данных исследования. Образцы группы сравнения, генотип которых отличается от генотипа образцов исследуемой группы, исключаются из дальнейшего анализа.
Филогенетический анализ полученных последовательностей проводится с использованием специализированного биоинформатического ПО (например, MEGA <54>). При проведении анализа рекомендуется рассчитать парные генетические дистанции для всех образцов, участвующих в исследовании, и построить филогенетическое дерево (дендрограмму). Для построения филогенетического дерева рекомендуется использовать наиболее достоверную биоинформатическую модель (General Time Reversible model в сочетании с использованием гамма-распределенных инвариантных позиций). Проверка филогении осуществляется методом статистического бутстрэпа с количеством повторов не менее 500.
--------------------------------
<54> megasoftware.net. Примечание: для проведения филогенетического анализа нуклеотидных последовательностей допускается применять ПО с аналогичными или лучшими характеристиками.
4.7.7. При проведении генотипирования и филогенетического анализа заполняется база данных. База данных представляет собой электронную таблицу, где для каждого образца указаны следующие сведения:
- идентификационный номер пациента;
- Ф.И.О. пациента (при наличии);
- относится ли данный образец к исследуемой или контрольной группе;
- субъект Российской Федерации, адрес фактического проживания;
- предположительные сроки инфицирования ГC;
- диагноз по МКБ-10;
- получал ли пациент лечение ГC;
- показатель последнего исследования на РНК ГC;
- дата последнего исследования на РНК ГC;
- Ф.И.О. специалиста, проводившего исследование.
4.8. Интерпретация результатов филогенетического анализа. При интерпретации результатов оценивается взаимное отношение пары образцов реципиент - потенциальный донор. В случае если в исследуемую группу включено более двух образцов, то оценивается каждая пара реципиент - потенциальный донор в отдельности.
Оценивается генотипический состав исследуемой группы. Если у пары образцов исследуемой группы обнаруживается различный субтип ВИЧ или генотип ГC, то эпидемиологическая связь между данными образцами признается маловероятной. Если у пары образцов исследуемой группы выявляется одинаковый субтип ВИЧ или генотип ВГC, то результат оценивается на основании генетической дистанции и филогенетического дерева.
Оценка генетической дистанции производится исходя из того, что генетическая дистанция между эпидемиологически связанными образцами меньше, чем между эпидемиологически несвязанными образцами. По данным исследований, генетическая дистанция между эпидемиологически связанными образцами ВИЧ по консервативному региону pol составляет менее 2%, а по вариабельному гену env - менее 5%. С осторожностью следует интерпретировать результат в случае наличия идентичных последовательностей (дистанция равна 0%) ввиду возможной контаминации образцов.
При анализе структуры филогенетического дерева попарно оцениваются отношения между образцами исследуемой группы и группы сравнения. Кроме того, оценивается достоверность образованных кластеров - достоверный кластер имеет уровень статистической бутстрэп поддержки более 70%. Если образец из исследуемой группы кластеризуется отдельно от других образцов исследуемой группы (генетическая дистанция между ним и образцами группы сравнения меньше, чем между ним и другими образцами исследуемой группы), делают вывод о том, что по результатам филогенетического анализа данный образец и остальные образцы исследуемой группы эпидемиологически не связаны друг с другом. Если образец из исследуемой группы образует достоверный монофилетический кластер совместно с другими образцами исследуемой группы (генетическая дистанция между ним и образцами из группы сравнения больше, чем между ним и другими образцами исследуемой группы), делают вывод о том, что результаты филогенетического анализа указывают на возможную эпидемиологическую связь между образцами в исследуемой группе.
4.8.1. На рис. 1 - 5 приведены примеры полученных филогенетических деревьев и рекомендации по их интерпретации.
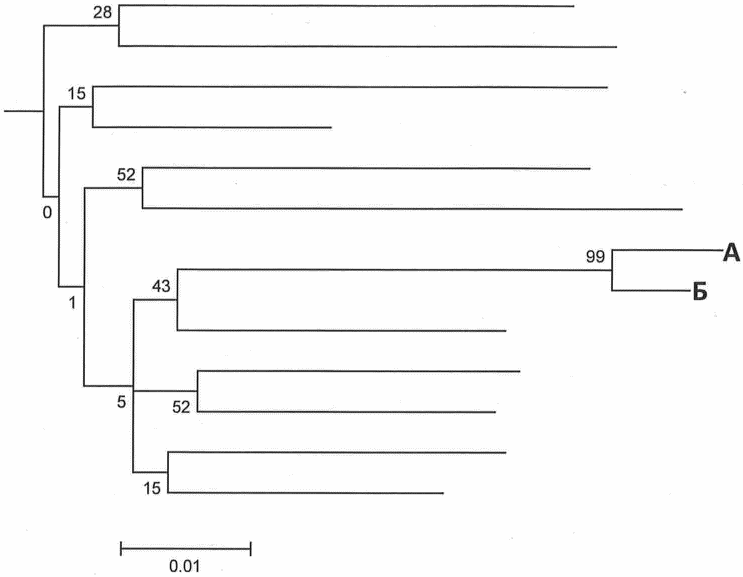
Рис. 1. Филогенетическое дерево 1
На филогенетическом дереве 1 нуклеотидные последовательности генома вируса, выделенные из образцов пациентов А и Б, образуют общий кластер - можно предположить наличие эпидемиологической связи между пациентами.
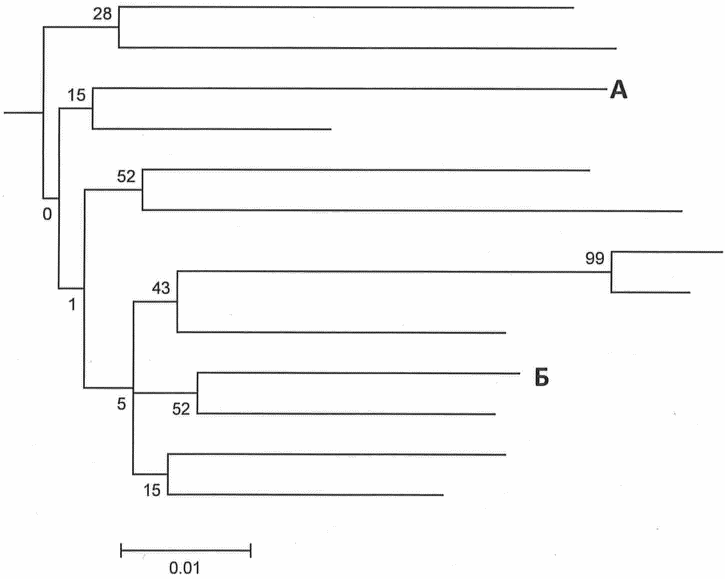
Рис. 2. Филогенетическое дерево 2
На филогенетическом дереве 2 нуклеотидные последовательности генома вируса, выделенные из образцов пациентов А и Б, не образуют общий кластер - с высокой долей вероятности пациенты А и Б эпидемиологически не связаны.
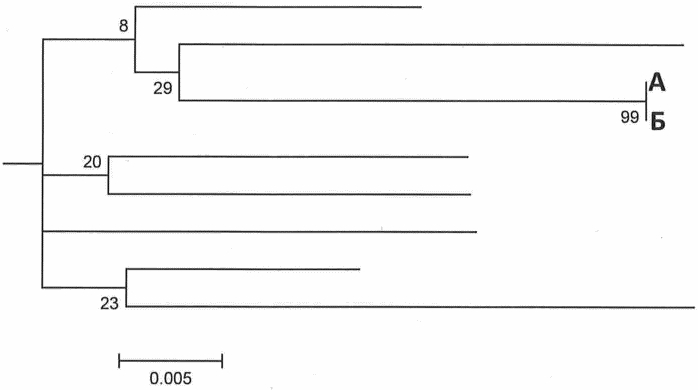
Рис. 3. Филогенетическое дерево 3.
А и Б образуют общий достоверный кластер (дистанция 0)
На филогенетическом дереве 3 нуклеотидные последовательности генома вируса, выделенные из образцов пациентов А и Б, образуют общий кластер - можно предположить наличие эпидемиологической связи между пациентами и заражение, произошедшее незадолго до забора образцов на анализ, но необходимо исключить вероятность контаминации. Рекомендуется повторить процедуру анализа, по возможности начиная с забора образцов.
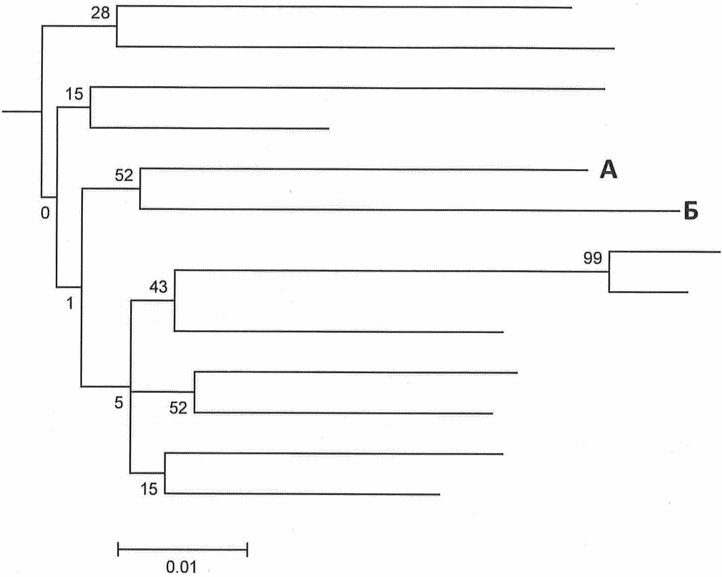
Рис. 4. Филогенетическое дерево 4
На филогенетическом дереве 4 нуклеотидные последовательности генома вируса, выделенные из образцов пациентов А и Б, образуют общий достоверный кластер - в кластере присутствует образец В группы сравнения. Можно предположить наличие эпидемиологической связи между пациентами, при этом с высокой долей вероятности образец В также связан с исследуемыми образцами.
Рис. 5. Филогенетическое дерево 5
На филогенетическом дереве 5 нуклеотидные последовательности генома вируса, выделенные из образцов пациентов А и Б, образуют общий кластер, имеющий низкую достоверность. Результат не валидный, возможной причиной является низкое качество последовательностей, рекомендуется повторное исследование с расширением группы сравнения и, при необходимости, повторный анализ с этапа получения нуклеотидных последовательностей.
- Гражданский кодекс (ГК РФ)
- Жилищный кодекс (ЖК РФ)
- Налоговый кодекс (НК РФ)
- Трудовой кодекс (ТК РФ)
- Уголовный кодекс (УК РФ)
- Бюджетный кодекс (БК РФ)
- Арбитражный процессуальный кодекс
- Конституция РФ
- Земельный кодекс (ЗК РФ)
- Лесной кодекс (ЛК РФ)
- Семейный кодекс (СК РФ)
- Уголовно-исполнительный кодекс
- Уголовно-процессуальный кодекс
- Производственный календарь на 2025 год
- МРОТ 2026
- ФЗ «О банкротстве»
- О защите прав потребителей (ЗОЗПП)
- Об исполнительном производстве
- О персональных данных
- О налогах на имущество физических лиц
- О средствах массовой информации
- Производственный календарь на 2026 год
- Федеральный закон "О полиции" N 3-ФЗ
- Расходы организации ПБУ 10/99
- Минимальный размер оплаты труда (МРОТ)
- Календарь бухгалтера на 2025 год
- Частичная мобилизация: обзор новостей
- Постановление Правительства РФ N 1875