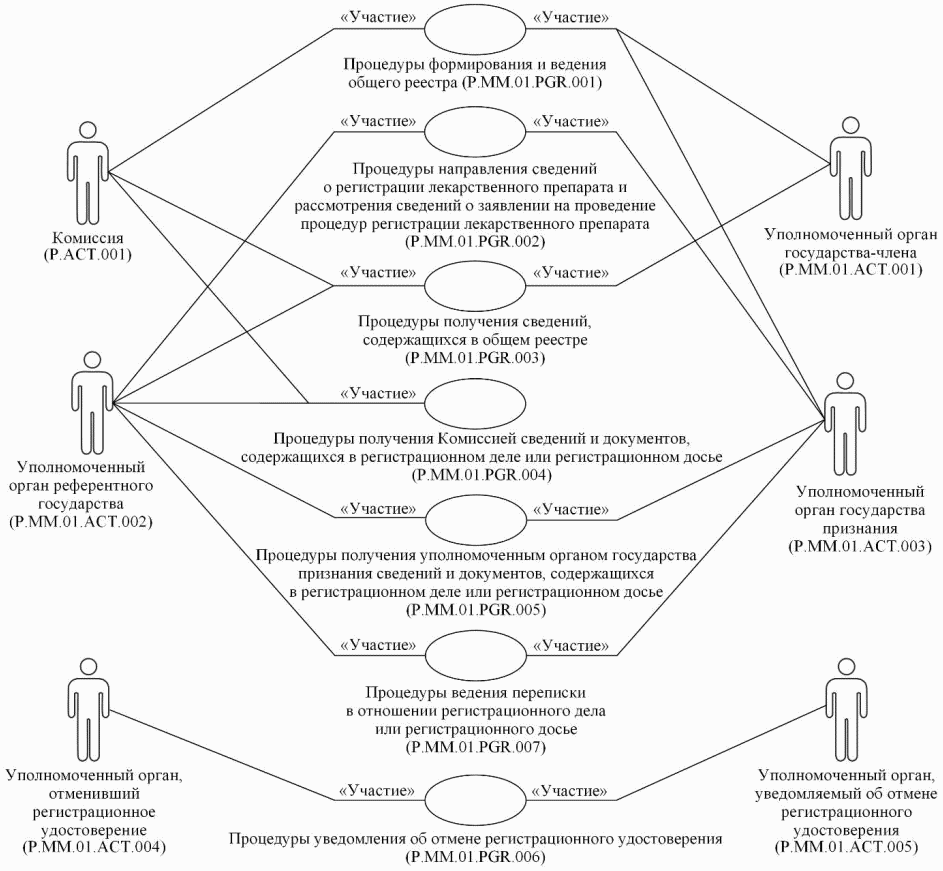
10. Общий процесс представляет собой совокупность процедур, сгруппированных по своему назначению:
а) процедуры формирования и ведения общего реестра;
б) процедуры направления сведений о регистрации лекарственного препарата и рассмотрения сведений о заявлении на проведение процедур регистрации лекарственного препарата;
в) процедуры получения сведений, содержащихся в общем реестре;
г) процедуры получения Комиссией сведений и документов, содержащихся в регистрационном деле или регистрационном досье;
д) процедуры получения уполномоченным органом государства признания сведений и документов, содержащихся в регистрационном деле или регистрационном досье;
е) процедуры уведомления об отмене регистрационного удостоверения;
ж) процедуры ведения переписки в отношении регистрационного дела или регистрационного досье.
11. При выполнении процедур общего процесса осуществляется формирование общего реестра на основании представляемых уполномоченными органами государств-членов в Комиссию сведений о зарегистрированных лекарственных препаратах, а также сведений о заявлениях на проведение процедур, связанных с регистрацией и экспертизой лекарственного препарата, предусмотренных Правилами регистрации (далее - сведения о заявлениях), представление сведений о регистрации лекарственных препаратов уполномоченным органам государств-членов средствами интегрированной системы, а также предоставление доступа к сведениям единого реестра на информационном портале Союза для заинтересованных лиц.
При выполнении уполномоченными органами государств-членов процедур регистрации, подтверждения регистрации (перерегистрации), внесения изменений в регистрационное досье или процедур, связанных с регистрацией лекарственного препарата, установленных Правилами регистрации (далее - процедуры регистрации), осуществляется формирование общего реестра за счет выполнения ими следующих процедур общего процесса, включенных в группу процедур формирования и ведения общего реестра:
включение сведений в общий реестр;
изменение сведений, содержащихся в общем реестре;
исключение сведений из общего реестра;
направление сведений о подлежащем размещению в едином реестре документе;
направление заключения о невозможности признания экспертного отчета.
Уникальный регистрационный номер заявления присваивается средствами интегрированной системы и возвращается уполномоченному органу референтного государства в рамках выполнения процедуры "Включение сведений в общий реестр" (P.MM.01.PRC.001). Уникальный регистрационный номер заявления присваивается средствами интегрированной системы и возвращается уполномоченному органу государства признания в рамках выполнения процедуры "Включение сведений в общий реестр" (P.MM.01.PRC.001) только при внесении изменений в регистрационное досье зарегистрированного лекарственного препарата без привлечения уполномоченного органа референтного государства в случаях, предусмотренных Правилами регистрации (пункт 2.1.5 Приложения N 19 Правил регистрации в редакции Решения Совета Комиссии от 29 мая 2024 г. N 43).
При рассмотрении уполномоченными органами государств-членов заявлений на проведение процедур регистрации лекарственного препарата, а также при изменении состава документов регистрационного дела или регистрационного досье на лекарственный препарат выполняются следующие процедуры общего процесса, включенные в группу процедур направления сведений о регистрации лекарственного препарата и рассмотрения сведений о заявлении на проведение процедур регистрации лекарственного препарата:
направление сведений о заявлении на проведение процедур регистрации лекарственного препарата;
уведомление о невозможности рассмотрения заявления на проведение процедур регистрации лекарственного препарата;
уведомление об изменении сведений о регистрации лекарственного препарата.
При представлении сведений о регистрации уполномоченным органам государств-членов выполняются следующие процедуры общего процесса, включенные в группу процедур получения уполномоченными органами государств-членов сведений, содержащихся в общем реестре:
получение информации о дате и времени обновления общего реестра;
получение актуальных сведений из общего реестра;
получение измененных сведений из общего реестра;
получение порядкового номера регистрационного удостоверения;
получение сведений о регистрации лекарственного препарата из общего реестра;
получение сведений о размещенном в едином реестре документе.
При возникновении необходимости получения Комиссией сведений и документов, содержащихся в регистрационном деле или регистрационном досье, при урегулировании разногласий на экспертном комитете по лекарственным средствам при Комиссии (далее - экспертный комитет) выполняются следующие процедуры общего процесса, включенные в группу процедур получения Комиссией сведений, содержащихся в регистрационном деле или регистрационном досье:
получение Комиссией сведений из регистрационного дела или регистрационного досье;
получение Комиссией документа из регистрационного дела или регистрационного досье.
При возникновении необходимости получения уполномоченным органом государства признания сведений и документов, содержащихся в регистрационном деле или регистрационном досье, при выполнении процедур регистрации лекарственного препарата, а также в иных случаях, предусмотренных Порядком ведения единого реестра, выполняются следующие процедуры общего процесса, включенные в группу процедур получения уполномоченным органом государства признания сведений, содержащихся в регистрационном деле или регистрационном досье:
получение сведений из регистрационного дела или регистрационного досье;
получение документа из регистрационного дела или регистрационного досье.
При принятии решения об отмене регистрационного удостоверения в случаях, предусмотренных Правилами регистрации, выполняется процедура общего процесса "Направление уведомления об отмене регистрационного удостоверения" (P.MM.01.PRC.013), включенная в группу процедур уведомления об отмене регистрационного удостоверения.
В рамках рассмотрения уполномоченными органами государств признания экспертного отчета об оценке безопасности, эффективности и качества (далее - экспертный отчет), оформленного уполномоченным органом референтного государства по результатам экспертизы лекарственного препарата, в том числе, при принятии решения о признании (непризнании) экспертного отчета, а также при необходимости направления вопросов и (или) замечаний в отношении документов регистрационного дела или регистрационного досье выполняются следующие процедуры общего процесса, включенные в группу процедур ведения переписки в отношении регистрационного дела или регистрационного досье:
направление экспертного отчета;
направление замечаний в отношении документов регистрационного дела или регистрационного досье;
направление решения о признании (непризнании) экспертного отчета.
Представляемые уполномоченными органами государств-членов в электронном виде документы регистрационного досье или регистрационного дела в формате *.pdf должны содержать текстовый слой.
Уникальным идентификатором документа является UUID (universally unique identifier), рассчитанный в соответствии с ISO/IEC 9834-8 по версии 5 (name-based version + SHA-1 hash), где в качестве идентификатора пространства имен (name space identifier) использован "nil UUID" (00000000-0000-0000-0000-000000000000), а в качестве имени (name) использована контрольная сумма, определенная по файлу документа алгоритмом SHA-1.
Передаваемые о регистрационном досье сведения должны содержать информацию по всем документам всех версий (последовательностях) электронного регистрационного досье, в т.ч. должны содержать xml-документы, полученные от заявителя.
Сведения, передаваемые о документе регистрационного досье, должны содержать известные отправителю реквизиты "Последовательность предоставления досье" и "Атрибут операции". При передаче сведений о документе регистрационного дела реквизит "Последовательность предоставления досье" указывается в соответствии с известной отправителю версией досье, по которой составлен этот документ регистрационного дела, а реквизит "Атрибут операции" не заполняется.
12. Приведенное описание структуры общего процесса представлено на рисунке 1.
Рис. 1. Структура общего процесса
13. Порядок выполнения процедур общего процесса, сгруппированных по своему назначению, включая детализированное описание операций, приведен в разделе VIII настоящих Правил.
14. Для каждой группы процедур приводится общая схема, демонстрирующая связи между процедурами общего процесса и порядок их выполнения. Общая схема процедур построена с использованием графической нотации UML (унифицированный язык моделирования - Unified Modeling Language) и снабжена текстовым описанием.
- Гражданский кодекс (ГК РФ)
- Жилищный кодекс (ЖК РФ)
- Налоговый кодекс (НК РФ)
- Трудовой кодекс (ТК РФ)
- Уголовный кодекс (УК РФ)
- Бюджетный кодекс (БК РФ)
- Арбитражный процессуальный кодекс
- Конституция РФ
- Земельный кодекс (ЗК РФ)
- Лесной кодекс (ЛК РФ)
- Семейный кодекс (СК РФ)
- Уголовно-исполнительный кодекс
- Уголовно-процессуальный кодекс
- Производственный календарь на 2025 год
- МРОТ 2025
- ФЗ «О банкротстве»
- О защите прав потребителей (ЗОЗПП)
- Об исполнительном производстве
- О персональных данных
- О налогах на имущество физических лиц
- О средствах массовой информации
- Производственный календарь на 2026 год
- Федеральный закон "О полиции" N 3-ФЗ
- Расходы организации ПБУ 10/99
- Минимальный размер оплаты труда (МРОТ)
- Календарь бухгалтера на 2025 год
- Частичная мобилизация: обзор новостей
- Постановление Правительства РФ N 1875