- Рекомендуется всем пациентам при постановке диагноза для верификации диагноза, во время лечения для оценки динамики на фоне терапии 2 - 3 раза в неделю выполнение общего (клинического) анализа крови развернутого (далее - ОАК) (с подсчетом лейкоцитарной формулы и исследованием уровня тромбоцитов) [1, 2, 4, 5].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: при диагностике ОЛЛ у части пациентов показатели крови могут быть нормальными. Число лейкоцитов может варьировать от 0,5 x 109/л до 700 x 109/л; увеличение числа лейкоцитов выше 10,0 x 109/л отмечается у 60% пациентов, выше 100,0 x 109/л - у 10%; тромбоцитопения менее 50,0 x 109/л определяется у 60% пациентов.
- Рекомендуется всем пациентам при постановке диагноза для определения объема опухолевого поражения, вероятности развития синдрома лизиса опухоли, а также всем пациентам во время лечения 2 раза в неделю с целью динамики изменений на фоне терапии и выявления осложнений выполнить анализ крови биохимический общетерапевтический (Исследование уровня общего белка в крови, Определение соотношения белковых фракций методом электрофореза, Исследование уровня мочевины в крови, Исследование уровня креатинина в крови, Исследование уровня общего билирубина в крови, Определение активности аспартатаминотрансферазы в крови (далее - АСТ), Определение активности аланинаминотрансферазы в крови (далее - АЛТ), Определение активности лактатдегидрогеназы в крови, Исследование уровня общего магния в сыворотке крови, Исследование уровня натрия в крови, Исследование уровня калия в крови, Исследование уровня общего кальция в крови, Исследование уровня глюкозы в крови) [1, 2, 4, 5, 17, 18].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: дополнительно при наличии показаний на любом этапе диагностики и лечения ОЛЛ могут исследоваться другие показатели крови: Исследование уровня железа сыворотки крови, Исследование уровня трансферрина сыворотки крови, Исследование уровня эритропоэтина крови, Исследование уровня фолиевой кислоты в сыворотке крови, Исследование уровня иммуноглобулинов в крови; Определение соотношения белковых фракций методом электрофореза; исследование функции нефронов по клиренсу креатинина (проба Реберга) и другие.
- Рекомендуется всем пациентам при подтверждении диагноза для определения вероятности развития тяжелых коагуляционных нарушений, как геморрагических, так и тромботических, а также всем пациентам во время лечения 2 раза в неделю, с целью выявления осложнений на фоне терапии выполнить скрининговое исследование свертывающей системы крови (активированное частичное тромбопластиновое время (далее - АЧТВ), Определение протромбинового (тромбопластинового) времени в крови или в плазме, Определение тромбинового времени в крови, Исследование уровня фибриногена в крови). Пациентам, получающим терапию аспарагиназой**, необходимо Определение активности антитромбина III в крови [19 - 22].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
Комментарии: при выявлении изменений в результатах скрининговых исследований и наличии клинических показаний исследуются дополнительные параметры коагуляции (например, исследование уровня продуктов паракоагуляции в крови, протеина C в крови, Определение активности протеина S в крови, антитромбина III, и другие).
- Рекомендуется всем пациентам выполнить исследование общего (клинического) анализа мочи с целью исключения поражения почек [1, 2, 4, 5, 23].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: при наличии показаний выполняются дополнительные исследования мочи, например, для исключения инфекции и уточнения типа возбудителя - исследование мочи методом Нечипоренко, исследование мочи методом Зимницкого, различные микробиологические (культуральные) исследования мочи и микроскопическое исследование мочи. Также по показаниям выполняются на любом этапе диагностики и лечения ОЛЛ исследование гемосидерина в моче, исследование уровня свободного кортизола в моче, определение активности альфа-амилазы в моче, и другие.
- Рекомендуется всем пациентам при подозрении и при установленном ОЛЛ, а также в ходе терапии с частотой 1 раз в 3 - 6 месяцев определение антител классов M, G (IgM, IgG) к вирусу иммунодефицита человека ВИЧ-1 (Human immunodeficiency virus HIV 1) в крови; определение антител классов M, G (IgM, IgG) к вирусу иммунодефицита человека ВИЧ-2 (Human immunodeficiency virus HIV 2) в крови для уточнения необходимости одновременного проведения противоопухолевой и антиретровирусной терапии, и определение антител к бледной трепонеме (Treponema pallidum) в крови для исключения сопутствующей патологии [1, 2].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Рекомендуется всем пациентам при подозрении и при подтвержденном ОЛЛ, а также в ходе терапии с частотой 1 раз в 3 - 6 месяцев выполнять определение антигена (HbsAg) вируса гепатита B (Hepatitis B virus) в крови и антигена вируса гепатита C (Hepatitis C virus) в крови и, при необходимости, молекулярно-биологическое исследование крови на вирус гепатита B (Hepatitis B virus) и гепатита C (Hepatitis C virus) в целях уточнения риска реактивации вирусного гепатита и, в случае необходимости, ее профилактики [24, 25].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
- Рекомендуется всем пациентам с ОЛЛ по показаниям с целью уточнения риска и в случае необходимости профилактики реактивации вирусного гепатита В выполнение развернутого вирусологического исследования для выявления маркеров вирусов гепатита B, которое должно включать определение [1, 2]:
- антигена (HbsAg) вируса гепатита B (Hepatitis B virus) в крови;
- антител к поверхностному антигену (HBsAg) вируса гепатита B (Hepatitis B virus) в крови;
- антител к ядерному антигену (HBcAg) вируса гепатита B (Hepatitis B virus) в крови;
- ДНК вируса гепатита B (Hepatitis B virus) в крови методом полимеразной цепной реакции (качественное исследование).
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Рекомендуется всем пациентам исследование микробиоценоза кишечника (дисбактериоз) культуральными методами с целью выявления колонизации нестерильных локусов патогенной флорой [26].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Рекомендуется пациентам при подозрении и при установленном ОЛЛ, в процессе лечения по показаниям, выполнение необходимых исследований и проб для гемотрансфузии, включающих [27, 240]:
-- определение основных групп по системе AB0;
-- определение антигена D системы Резус (резус-фактор);
-- определение подгруппы и других групп крови меньшего значения A-1, A-2, D, Cc, E, Kell, Duffy;
-- проба на совместимость перед переливанием компонентов крови;
-- определение фенотипа по антигенам C, c, E, e, Cw, K, k и определение антиэритроцитарных антител;:
-- определение содержания мембранных иммуноглобулинов;
-- определение содержания антилейкоцитарных антител;
-- определение содержания антитромбоцитарных антител;
-- определение содержания антител к антигенам эритроцитов в сыворотке крови.
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: назначение необходимых исследований и проб, а также выбор конкретного вида компонента крови для гемотрансфузии (тип эритроцитосодержащего компонента крови, тип концентрата тромбоцитов, тип препарата плазмы) осуществляется лечащим врачом или врачом-трансфузиологом в соответствии с клинической ситуаций и на основании Приказа Минздрава России от 28.10.2020 N 1170н "Об утверждении порядка оказания медицинской помощи населению по профилю "трансфузиология", Приказа Минздрава России от 20.10.2020 N 1134н "О порядке медицинского обследования реципиента, проведения проб на индивидуальную совместимость, включая биологическую пробу, при трансфузии донорской крови и (или) ее компонентов", рекомендациями "Клиническое использование эритроцитсодержащих компонентов крови" (2018 г.), Постановления от 22.06.2019 г. N 797 "Об утверждении правил заготовки, хранения, транспортировки и клинического использования донорской крови и ее компонентов и о признании утратившими силу некоторых актов Правительства Российской Федерации", другими нормативными актами (см. Приложение А3.9).
- Рекомендуются всем пациентам получение цитологического препарата КМ путем пункции (стернальная пункция, пункция задней ости подвздошной кости) и цитологическое исследование мазка КМ (миелограмма) из стернального пунктата с целью верификации диагноза и определения прогноза пациентов [1, 2, 4, 5, 11].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
Комментарии: диагноз ОЛ устанавливают при обнаружении в КМ 20% и более бластных клеток. Однако для ОЛЛ из клеток-предшественников лимофпоэза и для ЛБЛ из тех же клеток-предшественников существует иное общепринятное определение: диагноз ОЛЛ (B-клеточного или Т-клеточного) устанавливают при обнаружении 25% и более бластных клеток в КМ. Если процент бластных клеток в КМ менее 25% или бластные клетки отсутствуют в КМ, но присутствуют в иных очагах поражения (лимфатические узлы любой локализации, тимус, кожа, и т.д.), то устанавливают диагноз T- или B-ЛБЛ [1, 2, 4, 5].
- Рекомендуется всем пациентам выполнить цитохимическое исследование микропрепарата КМ (бластных клеток КМ) с целью верификации диагноза [28, 29].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
Комментарии: при цитохимическом исследовании бластные клетки оценивают как недифференцируемые, поскольку активность миелопероксидазы в них негативная, а PAS-позитивные гранулы, которые часто содержатся в них, не являются специфичным маркером, определяющим принадлежность к лимфоидной линии дифференцировки. Поэтому одним из ключевых методов диагностики ОЛЛ является иммунофенотипирование. Тем не менее, проведение цитохимических реакций на миелопероксидазу, неспецифическую эстеразу и гликоген является обязательным, так как определение линии дифференцировки бластных клеток осуществляется при комплексном анализе данных цитохимического исследования и иммунофенотипирования, при этом исключаются/верифицируются варианты острых лейкозов со смешанным фенотипом. [1, 2, 236].
- Рекомендуется выполнить патолого-анатомическое исследование биопсийного (операционного) материала очага поражения (опухолевого образования), в том числе с применением иммуногистохимических методов, у пациентов без поражения КМ с целью точной верификации диагноза [30].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Рекомендуется у всех пациентов с подозрением на ЛБЛ выполнять патолого-анатомическое исследование биопсийного (операционного) материала лимфоузла или другого очага поражения с применением иммуногистохимических методов с целью оценки субтипов ЛБЛ, а также сохранять биопсийный материал для последующего выполнения молекулярно-генетических исследований, что позволит разработать новые таргетные стратегии терапии [14].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: иммунофенотипические характеристики приблизительно 80% ЛБЛ характеризуются экспрессией T-клеточных маркеров, в отличие от ОЛЛ, при котором > 70% относятся к B-клеточным. Среди всех ЛБЛ доминирует T-клеточный субтип. Иммунофенотипические характеристики опухолевых клеток при Т-ЛБЛ позитивны по следующим маркерам: TdT, CD7 и цитоплазматическая CD3; вариабельны СD1a, CD2, CD4, СD5, CD8; может быть коэкспрессия CD4 и CD8, CD10 +/-; редко определяется коэкспрессия миеломаркеров CD13; 33; 117. В трети Т-ЛБЛ выявлены транслокации с участием генов Т-клеточных рецепторов ( ) и различных партнерских генов, включая MYC, TAL1, HOX11 и др.
) и различных партнерских генов, включая MYC, TAL1, HOX11 и др.
Иммунофенотипические характеристики опухолевых клеток при В-ЛБЛ позитивны: по ТdT (ядерная окраска), HLA-DR, CD19 и цитоплазматической (cyt) CD79a; CD20 и CD22 вариабельны. Иногда в цитоплазме определяются легкие цепи иммуноглобулина (cyt-![]() ). Поверхностные иммуноглобулины чаще отсутствуют, однако их обнаружение не исключает диагноза В-ЛБЛ; CD45 может быть негативен. Молекулярно-генетические особенности охарактеризованы мало, не имеют прогностического значения.
). Поверхностные иммуноглобулины чаще отсутствуют, однако их обнаружение не исключает диагноза В-ЛБЛ; CD45 может быть негативен. Молекулярно-генетические особенности охарактеризованы мало, не имеют прогностического значения.
- Рекомендуется всем пациентам выполнить иммунофенотипирование гемопоэтических клеток-предшественниц в КМ с целью верификации диагноза [31, 32].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
Комментарии: иммунофенотипирование выполняют с помощью мультипараметрической проточной цитофлуориметрии (обычно как минимум 6-цветной). Его используют для более четкого определения принадлежности бластных клеток к той или иной линии клеточной дифференцировки после установления морфологического диагноза ОЛЛ. Иммунофенотипическая характеристика бластных клеток при ОЛЛ представлена в приложении Г2. ОЛЛ из предшественников B-лимфоцитов (70 - 80% случаев) могут классифицироваться на четыре группы в соответствии со стадиями раннего развития B-клеток. ОЛЛ из предшественников Т-лимфоцитов (20 - 30% случаев) также могут делиться на 4 группы, в соответствии со стадиями раннего развития T-клеток. В ряде случаев бластные клетки имеют одновременно признаки как лимфоидной, так и миелоидной дифференцировки. Эти варианты ОЛ могут быть определены как острый лейкоз со смешанным фенотипом (MPAL) (B-/миелоидный, T-/миелоидный), если соответствуют необходимым критериям классификации ВОЗ (2017 г.) [3]. Другие случаи ОЛ могут отличаться отсутствием экспрессии необходимого сочетания или достаточного количества маркеров, которые позволили бы определить их линейную направленность. В таком случае могут быть диагностированы острый недифференцированный лейкоз или острый лейкоз неопределенной линейности, без дополнительного уточнения в соответствии с определениями, указанными в классификации ВОЗ.
В классификации ВОЗ 2017 г. отдельно выделяется лимфобластный лейкоз из ранних Т-клеточных предшественников (early T-precursor (ETP-ALL). Бластные клетки при ETP имеют признаки миелоидных и стволовых клеток, иммунофенотип должен соответствовать определенным критериям:
- T-линейная направленность (наличие экспресии cyCD3+CD7+)
- Отсутствие экспрессии CD1a и CD8 (< 5% позитивных бластных клеток)
- Отсутствие или слабая экспрессия CD5 (< 75% позитивных бластных клеток)
- позитивен хотя бы один из следующих маркеров: CD34, CD117, HLA-DR, CD13, CD33, CD11b, CD65 (![]() 25% позитивных бластных клеток).
25% позитивных бластных клеток).
В случае яркой и более мономорфной экспрессии CD5 (![]() 75%), но выполнении остальных критериев Т-лимфобластного лейкоза из ранних предшественников, устанавливается диагноз near-ETP-ALL, что можно перевести как "подобный-ETP-ALL".
75%), но выполнении остальных критериев Т-лимфобластного лейкоза из ранних предшественников, устанавливается диагноз near-ETP-ALL, что можно перевести как "подобный-ETP-ALL".
Приблизительно 80% ЛБЛ характеризуются экспрессией T-клеточных маркеров в отличие от ОЛЛ, при котором > 70% относятся к B-клеточным. Поэтому среди всех ЛБЛ доминирует T-клеточный субтип.
Иммуноморфологические характеристики опухолевых клеток при Т-ЛБЛ: позитивны терминальная дезоксинуклеотидилтрансфераза (далее - TdT), CD7 и цитоплазматическая CD3; вариабельны СD1a, CD2, CD4, СD5, CD8; может быть коэкспрессия CD4 и CD8, CD10 +/-; редко определяется коэкспрессия миеломаркеров CD13; 33; 117. В трети Т-ЛБЛ выявлены транслокации с участием генов Т-клеточных рецепторов (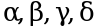 ) и различных партнерских генов, включая MYC, TAL1, HOX11 и др.
) и различных партнерских генов, включая MYC, TAL1, HOX11 и др.
Иммуноморфологические характеристики опухолевых клеток при В-ЛБЛ: позитивны: ТdT (ядерная окраска), HLA-DR, CD19 и цитоплазматическая (cyt) CD79a; CD20 и CD22 вариабельны. Поверхностные иммуноглобулины чаще отсутствуют, однако их обнаружение не исключает диагноза В-ЛБЛ; CD45 может быть негативен.
1. антигена (HbsAg) вируса гепатита B (Hepatitis B virus) в крови;
2. антител к поверхностному антигену (HBsAg) вируса гепатита B (Hepatitis B virus) в крови;
3. антител к ядерному антигену (HBcAg) вируса гепатита B (Hepatitis B virus) в крови;
- Рекомендуется всем пациентам при первичной диагностике ОЛЛ, а также при обследовании по поводу диагностированного рецидива ОЛЛ выполнить цитогенетическое исследование (кариотип) клеток аспирата КМ и исследование биопсийного (операционного) материала тканей или КМ с применением метода флуоресцентной гибридизации in situ (FISH) с целью верификации диагноза и определения группы риска и тактики лечения [3, 236].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: Цитогенетическое исследование клеток аспирата костного мозга должно включать кариотипирование и исследование методом флуоресцентной гибридизации in situ (FISH) для выявления характерных цитогенетических аномалий. В случае технических сложностей с получением аспирата костного мозга хромосомные аномалии могут устанавливаться на основании исследования клеток периферической крови при наличии более чем 10% циркулирующих опухолевых клеток. При отсутствии поражения КМ, которое бывает у пациентов с ЛБЛ, цитогенетическое исследование должно быть выполнено на субстрате биопсированного опухолевого образования.
Наиболее значимыми генетическими диагностическими и прогностическими факторами В-ОЛЛ у взрослых являются t (9;22) (q34; q11)/BCR::ABL1; t (11q23)/KMT2A (MLL) и t (1;19) (q23; p13)/TCF3::PBX1. Вариант В-ОЛЛ с t (12; 21) (р12; q22)/ETV6::RUNX1 характерен для детей, вариант В-ОЛЛ с iAMP21 в редких случаях встречаются также у молодых взрослых. При кариотипировании по возможности анализируют 20 метафаз для выявления хромосомных аберраций как в основном клоне, так и в возможных субклонах. Отсутствие выявленных аномалий при анализе менее 20 метафаз не может надежно исключать их наличие в опухолевом клоне. Всем больным В-клеточным ОЛЛ и ОЛ смешанного фенотипа выполняется исследование методом FISH на наличие t (9;22) (q34; q11)/BCR::ABL1 и t (v; 11q23)/KMT2A, если не были выявлены при кариотипировании. Детекция этих цитогенетических аномалий во время проведения предфазы определяет всю дальнейшую терапевтическую тактику.
В транслокациях с вовлечением локуса гена KMT2A (ранее MLL) могут участвовать более 100 хромосомных партнеров. При обнаружении перестройки в локусе гена KMT2A методом FISH, при возможности, следует провести исследование на наличие самых часто встречающихся транслокаций, таких как t (4; 11) (q21; q23)/KMT2A::AFF1, t (9; 11) (p21; q23)/KMT2A::MLLT3, t (11; 19) (q23; p13)/KMT2A::MLLT1, t (6; 11) (q27; q23)/KMT2A::AFDN, t (10; 11) (p12; q23)/MLLT10::KMT2A и t (11; 19) (q23; p13.1)/KMT2A::ELL, для мониторинга динамики опухолевого клона на фоне терапии методом ПЦР.
Учитывая выделение BCR::ABL1-подобного В-ОЛЛ в отдельную подгруппу, требующую в некоторых случаях отдельных терапевтических опций, крайне желательно при установлении диагноза или при резистентном течении заболевания определение с помощью метода FISH перестроек с вовлечением локусов генов CRLF2 (IGH::CRLF2, P2RY8::CRLF2), ABL1, ABL2, JAK2, EPOR, PDGFRB (CSF1R).
Больным Т-ОЛЛ из ранних предшественников (ETP ОЛЛ) желательно выполнить исследование методом FISH на наличие перестройки в локусе гена транскрипционного фактора Т-клеточной линии BCL11B/14q32. Транслокация BCL11B/14q32 встречается в 30% случаев ЕТР ОЛЛ и определяет более благоприятный прогноз заболевания по сравнению с ETP ОЛЛ без транслокации [236].
- Рекомендуется выполнить цитогенетическое исследование биопсийного (операционного) материала тканей или КМ с применением метода флуоресцентной гибридизации in situ (FISH) у всех больных с В-ОЛЛ со зрелым иммунофенотипом для определения транслокации с вовлечением локуса гена MYC, а в случае их обнаружения проводить дополнительное исследование на наличие транслокаций c вовлечением локусов генов BCL2 и BCL6 - с целью верификации double-/triple-hit В-ОЛЛ. [3, 236].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: Больных В-ОЛЛ с транслокациями MYC и/или BCL2 и BCL6 относят к группе высокого риска [236].
- Рекомендуется выполнить молекулярно-генетическое исследование точечных мутаций гена BCR::ABL1 (химерный ген, образованный слиянием области кластера разрывов на 22-й хромосоме и гена тирозин-киназы Абельсона на 9-й хромосоме); молекулярно-генетическое исследование минимальной остаточной болезни при лейкозах при помощи пациент-специфичных праймеров (молекулярно-генетические исследования на наличие MYC::IgH, MLL::AF4 и других, в зависимости от ранее выявленных цитогенетических поломок), с целью дальнейшего мониторирования эффективности ХТ и оценки минимальной остаточной болезни (МОБ) в рамках КИ всем пациентам с В-клеточным ОЛЛ [35 - 37].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
Комментарии: детекция молекулярных транскриптов при ОЛЛ с BCR::ABL1, MYC::IgH, MLL::AF4 необходима с целью мониторинга противоопухолевого ответа и принятия терапевтических решений. Молекулярное исследование других многочисленных поломок является в настоящее время за рубежом одним из ключевых методов стартификации пациентов на группы риска. Детекция химерных транскриптов, мутации генов, перестройки и дупликации генов доступны только в больших исследовательских центрах. На молекулярно-генетическом уровне транскрипт гена BCR::ABL1 может определяться посредством полимеразной цепной реакции с обратной транскрипцией (ОТ-ПЦР). Расположение точки разрыва в гене BCR приводит к тому, что белок p190BCR-ABL выявляется в 66,3% случаев Ph+ ОЛЛ, также у данных пациентов часто определяется белок p210BCR-ABL (31,2%). В остальных случаях определяются транскрипты обоих типов либо атипичные транскрипты. Определение точечных мутаций гена BCR::ABL1 может позволить определить резистентность к терапии ингибиторами тирозинкиназ и способствовать подбору таргетного препарата, который работает при возникновении мутаций.
- Рекомендуется всем пациентам выполнить молекулярно-генетическое исследование T-клеточной клональности (по генам бета-, гамма- и дельта-цепей T-клеточного рецептора) или молекулярно-генетическое исследование B-клеточной клональности (по генам IgH, IgK, IgL) в аспирате КМ с целью дальнейшей оценки молекулярного ответа и верификации диагноза при сложных диагностических случаях [38].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: с молекулярной точки зрения все случаи ОЛЛ развиваются из клеток-предшественников B- или T-лимфоцитов, поэтому все они демонстрируют клональные перестройки генов тяжелых цепей Ig и/или генов TCR. Этот феномен позволяет определять пациент-специфические перестройки и использовать их в качестве молекулярного маркера заболевания при мониторинге МОБ. Помимо пациент-специфических маркеров, ОЛЛ имеют большое количество генетических и молекулярных перестроек, мутаций, в которых участвуют различные гены. Перечень основных молекулярно-генетических аномалий, идентифицированных при ОЛЛ у взрослых и детей и используемых в настоящее время при молекулярной диагностике, приведен в приложении Г2. Данный перечень не является полным и представляет собой компромисс между современным и более адекватным молекулярным методом выявления или исключения аномалии и наиболее часто используемой методикой.
- Рекомендуется всем пациентам выполнить спинномозговую пункцию с цитологическим исследованием клеток спинномозговой жидкости (микроскопическое исследование спинномозговой жидкости, подсчет клеток в счетной камере) для исключения/подтверждения вовлечения ЦНС. Микроскопическое исследование спинномозговой жидкости необходимо выполнять всем пациентам при цитозе ![]() 5/мкл. Рекомендуется с целью повышения точности анализа использовать для приготовления цитологических препаратов ликвора цитологическую центрифугу [12, 39].
5/мкл. Рекомендуется с целью повышения точности анализа использовать для приготовления цитологических препаратов ликвора цитологическую центрифугу [12, 39].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: при всех вариантах ОЛЛ высока вероятность вовлечения оболочек головного мозга. Поэтому всем пациентам показано выполнение диагностической спинномозговой пункции с морфологическим исследованием спинномозговой жидкости. Если уровень тромбоцитов не удается повысить до 30 x 109/л и выше, от пункции можно воздержаться до восстановления показателей тромбоцитов после курса. Если у пациентов определяется лейкоцитоз выше 30 x 109/л, то первую спинномозговую пункцию следует отложить до редукции числа лейкоцитов менее 10 x 109/л. Проведение иммунофенотпического исследования спинномозговой жидкости в части случаев позволяет верифицировать этиологию повреждения при наличии цитоза, особенно в диагностически сложных случаях необходимости верификации специфического поражения, инфекционного или токсического.
- Рекомендуется всем пациентам при диагностике нейролейкемии увеличить частоту спинномозговых пункций и выполнять их в среднем 1 раз в 3 дня до получения трех спинномозговых пункций без бластных клеток в спинномозговой жидкости, затем частоту пункций можно снизить до 1 пункции в неделю во время индукции (во время дальнейших этапов терапии спинномозговые пункции выполняются в соответствии с протоколом) для контроля динамики заболевания на терапии [1, 2, 4, 5].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: в рамках общей программы ХТ всем пациентам с ОЛЛ необходима терапия поражения ЦНС. В отсутствие профилактики поражения мозговых оболочек рецидивы в ЦНС в течение нескольких месяцев с момента регистрации ПР возникают приблизительно у трети пациентов. Рецидив в ЦНС при ОЛЛ у взрослых характеризуется неблагоприятным прогнозом, поскольку за ним обычно следует гематологический рецидив. При этом подходы к лечению поражения ЦНС и его профилактике различаются и учитывают характеристики пациента, его возраст и другие прогностические факторы.
- Рекомендуется у всех выделять и сохранять первичную ДНК или РНК из клеток КМ пациентов в биобанке или направлять материал на хранение в лаборатории федеральных центров для возможности последующего выполнения молекулярных исследований [40].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: сохранение первичного биологического материала (ДНК, выделенная из костномозговых клеток, или замороженные клетки) для выполнения в будущем молекулярных исследований, позволяющих четко определить группы риска.
- Рекомендуется всем пациентам, у которых при получении цитологического препарата КМ путем пункции (стернальной пункции) не получен диагностический материал (так называемый "сухой пунктат"), выполнять гистологическое и иммуногистохимическое исследование препарата КМ (трепанобиопсия), а также цитологическое и цитохимическое исследование (при наличии бластных клеток) отпечатков трепанобиоптата КМ с целью верификации точного диагноза [29, 30].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
- Не рекомендуется выполнять пункционную (аспирационную) биопсию очага поражения (опухолевого экстрамедуллярного образования) в связи с малой информативностью исследований данного материала [1, 2]
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Рекомендуется всем пациентам с ОЛЛ при проведении пункции любого органа и ткани и/или аспирации биологического материала выполнение исследований пунктата/аспирата для дифференциальной диагностики специфического лейкозного и иного типа поражения [1, 2]:
- Цитологическое исследование и просмотр цитологического препарата
- Цитохимическое исследование биологического материала (при наличии бластных клеток)
- Иммунофенотипирование биологического материала для выявления маркеров гемобластозов (при наличии бластных клеток по данным морфологического исследования)
Уровень убедительности рекомендации - C (уровень достоверности доказательств - 5)
Комментарии: наиболее часто выполняется пункция плевральной полости с цитологическим исследованием плевральной жидкости, бронхо-альвеолярный лаваж с цитологическим исследованием лаважной жидкости, спинномозговая пункция с цитологическим исследованием клеток спинномозговой жидкости, однако по показаниям может выполняться пункция любого доступного органа и ткани с последующим цитологическим исследованием, в том числе - микропрепарата тканей полости рта, перитонеальной жидкости, микропрепарата кожи, препарата тканей лимфоузла, пунктатов опухолей, опухолеподобных образований костей, тканей печени, тканей толстой кишки, аспирата из полости матки, тканей влагалища, тканей матки, тканей предстательной железы, тканей яичка, почки, мочевого пузыря, пунктатов и отпечатков биоптатов опухолей забрюшинного пространства. Биологический материал, полученный после аспирации/пункции, при подтверждении информативности полученного материала (наличие опухолевых клеток) может быть отправлен на цитогенетические и молекулярные исследования для верификации варианта заболевания
- Рекомендуется всем пациентам с ОЛЛ при проведении пункции с получением экссудата (жидкого биологического материала) выполнение дополнительных исследований для дифференциальной диагностики специфического лейкозного, инфекционного и иного типа поражения [1, 2]:
- При исследовании спинномозговой жидкости (ликвора):
-- Цитологическое исследование спинномозговой жидкости, подсчет клеток в счетной камере (определение цитоза)
-- Иммунофенотипическое исследование бластных клеток спинномозговой жидкости (при возможности)
-- Исследование уровня глюкозы в спинномозговой жидкости
-- Исследование уровня белка в спинномозговой жидкости
-- Тесты на аномальный белок в спинномозговой жидкости (при необходимости)
-- Определение концентрации водородных ионов (pH) в спинномозговой жидкости
-- Исследование уровня хлоридов в спинномозговой жидкости (при необходимости)
-- Микробиологическое (культуральное) исследование спинномозговой жидкости на различные бактерии, грибы
-- Молекулярно-биологическое исследование спинномозговой жидкости на различные бактерии, грибы, вирусы
- При исследовании плевральной жидкости
-- Микроскопическое исследование нативного и окрашенного препарата плевральной жидкости
-- Исследование уровня белка в плевральной жидкости
-- Микробиологическое (культуральное) исследование плевральной жидкости на различные бактерии, грибы.
-- Молекулярно-биологическое исследование плевральной жидкости на различные бактерии, грибы, вирусы
- При исследовании бронхоальвеолярной или асцитической жидкости
-- Микроскопическое исследование лаважной жидкости
-- Микроскопическое исследование перитонеальной (асцитической) жидкости
-- Микробиологическое (культуральное) исследование бронхоальвеолярной жидкости или асцитической жидкости на различные бактерии, грибы
-- Молекулярно-биологическое исследование бронхоальвеолярной или асцитической жидкости на различные бактерии, грибы, вирусы
Уровень убедительности рекомендации - C (уровень достоверности доказательств - 5)
- Рекомендуется всем пациентам с ОЛЛ при проведении биопсии любого органа и ткани выполнение макроскопического исследования удаленного операционного материала, гистологического исследования биопсийного (операционного) материала биоптата, в том числе, с применением иммуногистохимических методов, для дифференциальной диагностики специфического лейкозного поражения и иного типа поражения биопсированного органа, ткани [1, 2].
Уровень убедительности рекомендации - C (уровень достоверности доказательств - 5)
Комментарии: наиболее часто выполняется биопсия очага поражения кожи, костного мозга (трепанобиопсия), лимфоузла. Однако по показаниям может выполняться биопсия любого органа и ткани, в том числе, слизистой полости рта, слизистой оболочки полости носа, тканей легкого, опухоли средостения, селезенки, печени, пищевода, желудка, толстой кишки, молочной железы, кости, женских половых органов, предстательной железы, мужских половых органов, мочевого пузыря, почки, тканей забрюшинного пространства.
- Рекомендуется всем пациентам с ОЛЛ на любом этапе диагностики и лечения по показаниям выполнять исследование кала на скрытую кровь для исключения кишечного кровотечения как осложнения цитопении [1, 2].
Уровень убедительности рекомендации - C (уровень достоверности доказательств - 5)
- Гражданский кодекс (ГК РФ)
- Жилищный кодекс (ЖК РФ)
- Налоговый кодекс (НК РФ)
- Трудовой кодекс (ТК РФ)
- Уголовный кодекс (УК РФ)
- Бюджетный кодекс (БК РФ)
- Арбитражный процессуальный кодекс
- Конституция РФ
- Земельный кодекс (ЗК РФ)
- Лесной кодекс (ЛК РФ)
- Семейный кодекс (СК РФ)
- Уголовно-исполнительный кодекс
- Уголовно-процессуальный кодекс
- Производственный календарь на 2025 год
- МРОТ 2025
- ФЗ «О банкротстве»
- О защите прав потребителей (ЗОЗПП)
- Об исполнительном производстве
- О персональных данных
- О налогах на имущество физических лиц
- О средствах массовой информации
- Производственный календарь на 2026 год
- Федеральный закон "О полиции" N 3-ФЗ
- Расходы организации ПБУ 10/99
- Минимальный размер оплаты труда (МРОТ)
- Календарь бухгалтера на 2025 год
- Частичная мобилизация: обзор новостей
- Постановление Правительства РФ N 1875