1.2. Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
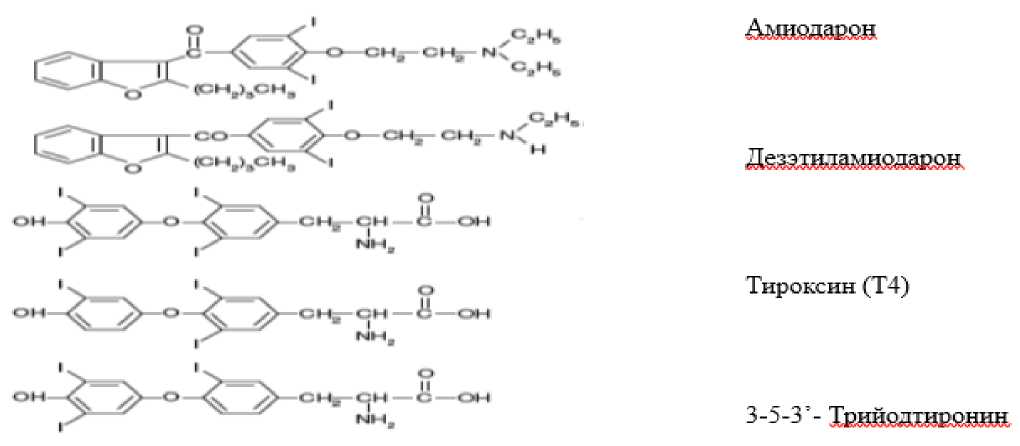
Этиологическим фактором развития амиодарон-индуцированной дисфункции ЩЖ является прием Ам** - широко используемого Антиаритмического препарата, класс III. Ам** имеет электрофизиологические эффекты, присущие всем четырем классам антиаритмических препаратов (C01: Препараты для лечения заболеваний сердца), с наиболее выраженным эффектом III класса (удлинение потенциала действия кардиомиоцита). Ам** в 1985 году был одобрен FDA для лечения рецидивирующих жизнеугрожающих желудочковых нарушений ритма [1]. В настоящее время Ам** применяют для лечения различных наджелудочковых и желудочковых аритмий [2, 3]. Ам** представляет собой производное бензофурана, молекула которого напоминает таковую основного гормона ЩЖ - тироксина (рис. 1). Каждая молекула Ам** содержит 2 атома йода, что составляет примерно 37% ее молекулярного веса [4 - 6]. Прием 200 - 600 мг Ам** в день приводит к поступлению в циркуляторное русло от 7 до 21 мг свободного йода, что превышает суточную потребность в йоде (150 - 250 мкг) в 40 - 140 раз. Ам** и, в большей степени, его активный метаболит ДЭАм, оказывают прямое дозозависимое цитотоксическое действие на фолликулярные клетки ЩЖ [7]. Кроме того, и Ам**, и ДЭАм, обладают способностью к накоплению в различных тканях и органах: в основном, в жировой ткани, печени, легких, и, в меньшей степени, в сердце, почках, мышцах и ЩЖ [8]. Оба, Ам** и ДЭАм, длительно сохраняются в организме (период полужизни составляет в среднем 52,6 ![]() 23,7 и 61,2
23,7 и 61,2 ![]() 31,2 дня, соответственно) [8, 9], при этом при ожирении клиренс дополнительно снижается на 22%, а у лиц старше 65 лет - на 46% [10]. Такие особенности метаболизма лекарственного препарата приводят к тому, что и Ам**, и его метаболит ДЭАм, длительно сохраняются в циркуляции после прекращения лечения [4, 11], а значение соотношения ДЭАм/Ам**, по мнению некоторых исследователей, может быть использовано в качестве предиктора того или иного варианта развития нарушения функции ЩЖ. Так, повышение соотношения ДЭАм/Ам характерно для развития АиТ, а его снижение для развития АиГ [12]. У большинства людей (около 80%), получающих Ам**, нарушения функции ЩЖ не развиваются в течение всего периода лечения [13]. Однако терапия Ам** может приводить к развитию как АиГ, так и АиТ [5, 14, 15 - 18].
31,2 дня, соответственно) [8, 9], при этом при ожирении клиренс дополнительно снижается на 22%, а у лиц старше 65 лет - на 46% [10]. Такие особенности метаболизма лекарственного препарата приводят к тому, что и Ам**, и его метаболит ДЭАм, длительно сохраняются в циркуляции после прекращения лечения [4, 11], а значение соотношения ДЭАм/Ам**, по мнению некоторых исследователей, может быть использовано в качестве предиктора того или иного варианта развития нарушения функции ЩЖ. Так, повышение соотношения ДЭАм/Ам характерно для развития АиТ, а его снижение для развития АиГ [12]. У большинства людей (около 80%), получающих Ам**, нарушения функции ЩЖ не развиваются в течение всего периода лечения [13]. Однако терапия Ам** может приводить к развитию как АиГ, так и АиТ [5, 14, 15 - 18].
Рис. 1 Химическая формула амиодарона**, дезэтиламиодарона и тиреоидных гормонов [5]
Наиболее известный патогенетический механизм развития АиГ заключается в том, что ЩЖ, пораженная аутоиммунным процессом, в условиях хронического поступления йода в большом количестве, не способна к ускользанию от эффекта Вольфа-Чайкова. В результате, продукция тиреоидных гормонов снижается и развивается гипотиреоз. Более того, имеются данные о том, что значительное поступление йода может нарушать его органификацию даже в нормальной ЩЖ [19]. Кроме перечисленных, к факторам, повышающим риск развития йод-индуцированного гипотиреоза, относят также наличие в анамнезе гемитиреоидэктомии по поводу узлового нетоксического зоба, лечения гипертиреоза, талассемии (тиреоидный гемосидероз) и хронической болезни почек [20]. Что касается срока развития АиГ после начала терапии Ам**, то он варьирует от нескольких недель до 39 месяцев [21]. Несмотря на то, что АиГ может быть обнаружен у пациентов с неизмененной ЩЖ, наличие предсуществующего хронического аутоиммунного тиреоидита значительно увеличивает риск его развития. Кроме того, АиГ чаще развивается у женщин и лиц старшего возраста. Сочетание женского пола и носительства антитиреоидных антител увеличивает относительный риск развития АиГ в 13,5 по сравнению с мужчинами без антител [11].
Различают два типа АиТ. АиТ1 обычно развивается у пациентов с узловым зобом или латентной БГ. В случае узлового зоба (размер узла или узлов обычно более 1,5 - 2 см), поступление в ЩЖ йода - основного субстрата для синтеза тиреоидных гормонов, приводит к неконтролируемой продукции последних. В результате развивается автономный тиреотоксикоз (многоузловой токсический зоб или токсическая аденома ЩЖ). При наличии латентной (или недиагностированной) БГ приток большого количества йода также приводит к увеличению биосинтеза тиреоидных гормонов и развитию тиреотоксикоза. АиТ2 или деструктивный тиреоидит - это следствие ассоциированного с йодом и/или Ам** воспаления и деструкции ЩЖ, и поступления в циркуляцию уже синтезированных в ЩЖ тиреоидных гормонов. Выделяют также смешанный (вызванный сочетанием деструкции фолликулярного эпителия ЩЖ с гиперпродукцией тиреоидных гормонов) тип АиТ [22].
- Гражданский кодекс (ГК РФ)
- Жилищный кодекс (ЖК РФ)
- Налоговый кодекс (НК РФ)
- Трудовой кодекс (ТК РФ)
- Уголовный кодекс (УК РФ)
- Бюджетный кодекс (БК РФ)
- Арбитражный процессуальный кодекс
- Конституция РФ
- Земельный кодекс (ЗК РФ)
- Лесной кодекс (ЛК РФ)
- Семейный кодекс (СК РФ)
- Уголовно-исполнительный кодекс
- Уголовно-процессуальный кодекс
- Производственный календарь на 2025 год
- МРОТ 2026
- ФЗ «О банкротстве»
- О защите прав потребителей (ЗОЗПП)
- Об исполнительном производстве
- О персональных данных
- О налогах на имущество физических лиц
- О средствах массовой информации
- Производственный календарь на 2026 год
- Федеральный закон "О полиции" N 3-ФЗ
- Расходы организации ПБУ 10/99
- Минимальный размер оплаты труда (МРОТ)
- Календарь бухгалтера на 2025 год
- Частичная мобилизация: обзор новостей
- Постановление Правительства РФ N 1875