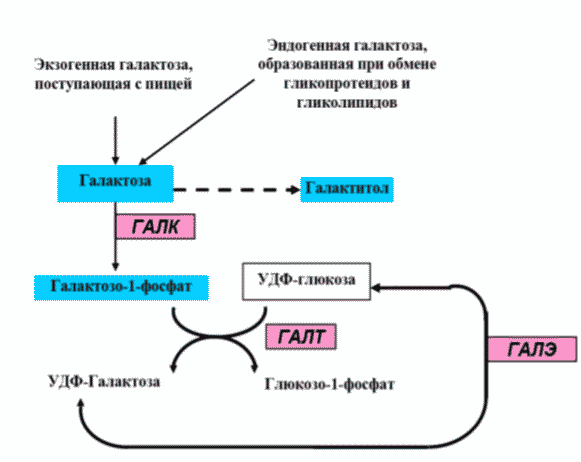
Галактоза (от греческого слова galaktos - молоко) - моносахарид из группы гексоз, изомер глюкозы. Несмотря на большое сходство молекул глюкозы и галактозы, превращение последней в глюкозу требует нескольких ферментативных реакций, которые протекают в цитоплазме клетки (рис. 1). Галактоза имеет важнейшее значение для роста и развития организма и является компонентом грудного молока.
Галактоза не только является значимым источником энергии для клетки, она играет важную пребиотическую роль, служит необходимым пластическим материалом для образования гликопротеидов, гликолипидов и других сложных соединений, используемых организмом для формирования клеточных мембран, нервной ткани, процессов миелинизации нейронов и др. Нарушение метаболизма галактозы, наблюдаемое при галактоземии, неизбежно приводит к расстройству функционирования многих органов и систем организма.
Большое количество потребляемых в течение дня пищевых продуктов (в первую очередь молочные продукты) содержат лактозу, из которой в кишечнике в результате гидролиза образуется галактоза; некоторые продукты питания содержат галактозу в чистом виде. У человека галактоза может образовываться эндогенным путем, подавляющее ее количество синтезируется в процессе ферментативных реакций между уридиндифосфатглюкозой (УДФ-глюкозой) и УДФ-галактозой, а также в процессе обмена гликопротеинов и гликолипидов.
Галактоземия относится к наследственным болезням углеводного обмена и объединяет несколько генетических форм заболеваний. Галактоземия тип I (ГАЛ I) обусловлена мутациями в гене GALT, картированном на 9p13.3, что приводит к дефициту галактозо-1-фосфатуридилтрансферазы (ГАЛТ). Галактоземия тип II (ГАЛ II) обусловлена мутациями в гене GALK1, картированном на 17q25.1, что приводит к дефициту галактокиназы (ГАЛК). Галактоземия тип III (ГАЛ III) обусловлена мутациями в гене GALE, картированном на 1p36.11, что приводит к дефициту уридин-дифосфат (УДФ)-галактозо-4-эпимеразы (ГАЛЭ) (рис 1).
В результате недостаточности любого из трех ферментов - ГАЛТ, ГАЛК или ГАЛЭ - в крови повышается концентрация галактозы. При снижении активности ферментов ГАЛТ и ГАЛЭ, помимо избытка галактозы, в организме пациента накапливается также избыточное количество галактозо-1-фосфата, что на сегодняшний день считается основным патогенетическим фактором, обусловливающим большинство клинических проявлений ГАЛ и формирование отсроченных осложнений. Избыток галактозы в организме может метаболизироваться в других биохимических путях: она может превращаться в галактитол. Накопление галактитола в крови и тканях и повышение его экскреции с мочой наблюдается при всех формах ГАЛ; в хрусталике глаза избыток галактитола способствует формированию катаракты. Имеются сведения о том, что высокое содержание галактитола в тканях мозга способствует набуханию нервных клеток и формированию псевдоопухоли мозга у отдельных пациентов.
Патологические процессы при ГАЛ обусловлены не только токсическим действием указанных продуктов, но и их тормозящим влиянием на активность других ферментов, участвующих в углеводном обмене (фосфоглюкомутазы, глюкозо-6-фосфатдегидрогеназы), следствием чего является гипогликемический синдром. Предполагается также, что предрасположенность к сепсису у новорожденных с ГАЛ тип I обусловлена ингибированием бактерицидной активности лейкоцитов.
Наиболее частой формой ГАЛ является ГАЛ I. Ген GALT состоит из 11 экзонов, охватывающих 4,3 т.п.н. хромосомы 9p13. В базе данных по мутациям человека Human Genetic Mutaton Database (HGMD Professional, Version 2020.3) описано 346 патогенных вариантов в гене GALT [47]. К наиболее распространенным патогенным вариантам относятся: c.563A>G (p.Q188R) и c.855G>T (p.K285N), обуславливающие развитие ГАЛ I. Среди пациентов европейского происхождения наиболее частым патогенным вариантом является c.563A> G (p.Q188R), составляющий 64% всех наблюдаемых патогенных вариантов. Вариант c.404C> T (p.S135L) связан с "мягким" фенотипом ГАЛ I и встречается почти исключительно у пациентов африканского происхождения. Другие распространенные патогенные варианты включают: c.855G> T (p.K285N), c.626A> G (p.Y209C), c.413C> T (p.T138M), c.584T> C (p.L195P) и IVS2-2А> G. У евреев-ашкенази часто встречается делеция размером около 5,5 kb. Все эти варианты связаны с почти или полной потерей активности фермента.
Вариант галактоземия-Дуарте (GD2) является результатом сложной гетерозиготности по патогенному варианту GALT (G) и второму аллелю, известному как p.N314D, Duarte 2 (D2). D2 встречается примерно у 11% населения в европейско-американских популяциях. В настоящее время известно, что он включает гаплотип из пяти вариантов: три интронных варианта (- c.378-27G>C, c.508-24G>A и c.507+62G>A), делецию 4 п.н. в промоторе гена и замену c.940A> G (p.N314D). Аллель D2 снижает активность ГАЛТ примерно на 50%, так что, когда он присутствует в транс-положении с классическим аллелем галактоземии, то активность фермента может составлять ~ 25% от нормы. Текущие данные подтверждают гипотезу о том, что делеция 4 п.н. ответственна за снижение активности фермента. Второй вариант, Duarte 1 (D1, также известный как вариант Лос-Анджелеса или LA), не связан со сниженной активностью ГАЛТ. Аллель D1 содержит c.940A> G (p.N314D), а также синонимичное изменение нуклеотида в экзоне 7, c.652C> T (p.L218 =), но не делецию промотора 4 п.н. Аллель варианта D1 также считается доброкачественным и ассоциируется с нормальной или слегка повышенной активностью фермента ГАЛТ эритроцитов [16].
Галактоземии II типа (ГАЛ II) обусловлена вариантами в гене GALK1, картированном на 17q25.1. Описано около 50 патогенных вариантов, частых среди них не описано. Один вариант, p.P28T, чаще встречается у цыган [17].
Галактоземия тип III (ГАЛ III) обусловлена патогенными вариантами в гене GALE, картированном на 1p36.11. Одна из самых редких форм ГАЛ. Известно около 30 каузативных вариантов, частых среди них не описано.
Рисунок 1. Метаболизм галактозы
- Гражданский кодекс (ГК РФ)
- Жилищный кодекс (ЖК РФ)
- Налоговый кодекс (НК РФ)
- Трудовой кодекс (ТК РФ)
- Уголовный кодекс (УК РФ)
- Бюджетный кодекс (БК РФ)
- Арбитражный процессуальный кодекс
- Конституция РФ
- Земельный кодекс (ЗК РФ)
- Лесной кодекс (ЛК РФ)
- Семейный кодекс (СК РФ)
- Уголовно-исполнительный кодекс
- Уголовно-процессуальный кодекс
- Производственный календарь на 2025 год
- МРОТ 2026
- ФЗ «О банкротстве»
- О защите прав потребителей (ЗОЗПП)
- Об исполнительном производстве
- О персональных данных
- О налогах на имущество физических лиц
- О средствах массовой информации
- Производственный календарь на 2026 год
- Федеральный закон "О полиции" N 3-ФЗ
- Расходы организации ПБУ 10/99
- Минимальный размер оплаты труда (МРОТ)
- Календарь бухгалтера на 2025 год
- Частичная мобилизация: обзор новостей
- Постановление Правительства РФ N 1875