4. Группа процедур обмена сведениями о планах (графиках), результатах фармацевтических инспекций и сертификатах
4. Группа процедур обмена сведениями о планах (графиках),
результатах фармацевтических инспекций и сертификатах
15. Процедуры обмена сведениями о планах (графиках), результатах фармацевтических инспекций и сертификатах выполняются при осуществлении планирования и проведения фармацевтических инспекций.
В рамках процедур обмена сведениями о планах (графиках), результатах фармацевтических инспекций и сертификатах Комиссией на основании сведений, формируемых и представляемых уполномоченными органами, обеспечивается формирование и ведение базы данных о фармацевтических инспекциях, включающей сведения о планах (графиках) проведения инспекций, сведения о результатах фармацевтических инспекций, сведения о результатах устранения инспектируемым субъектом критических несоответствий, выявленных при проведении фармацевтических инспекций, а также сведения о выдаче, внесении изменений, приостановлении, возобновлении или прекращении действия сертификатов.
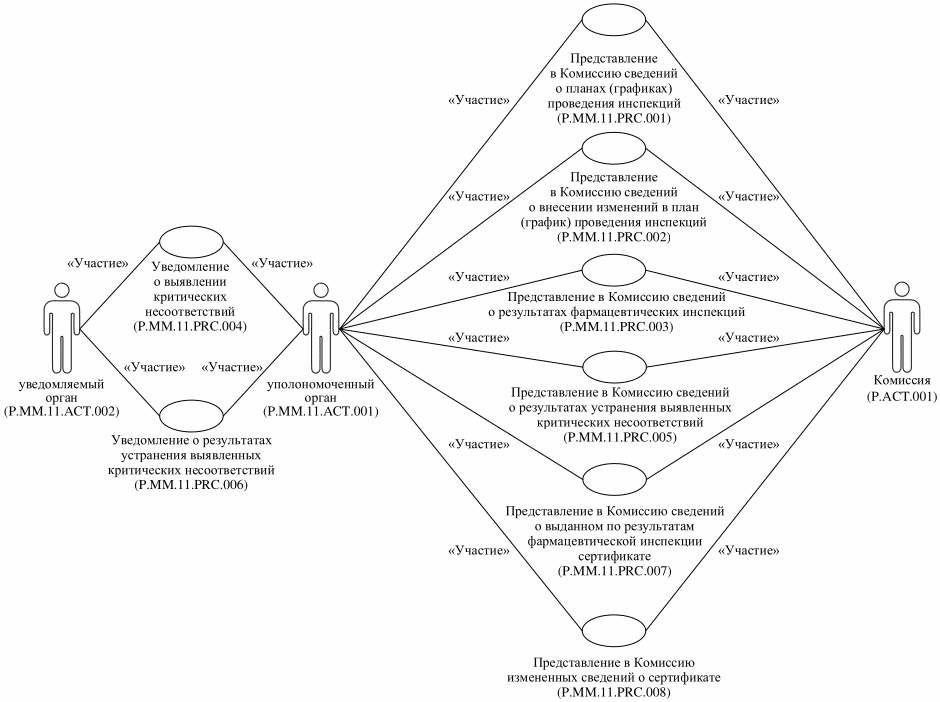
С целью обеспечения уполномоченных органов, заинтересованных органов и заинтересованных лиц актуальными сведениями о планах (графиках) проведения инспекций выполняется процедура "Представление в Комиссию сведений о планах (графиках) проведения инспекций" (P.MM.11.PRC.001), в рамках которой уполномоченные органы представляют в Комиссию сведения о планах (графиках) проведения инспекций для включения в базу данных о фармацевтических инспекциях и опубликования Комиссией общедоступных сведений о планах (графиках) проведения инспекций на информационном портале Союза.
При необходимости актуализации ранее включенных в базу данных о фармацевтических инспекциях и опубликованных на информационном портале Союза сведений о планах (графиках) проведения инспекций выполняется процедура "Представление в Комиссию сведений о внесении изменений в план (график) проведения инспекций" (P.MM.11.PRC.002), в рамках которой уполномоченные органы представляют в Комиссию сведения о внесении изменений в планы (графики) проведения инспекций, для включения и актуализации таких сведений в базе данных о фармацевтических инспекциях, а также для актуализации опубликованных Комиссией общедоступных сведений о планах (графиках) проведения инспекций на информационном портале Союза.
В случае завершения инспектирования с целью обеспечения уполномоченных органов и заинтересованных органов актуальными сведениями о результатах фармацевтических инспекций выполняется процедура "Представление в Комиссию сведений о результатах фармацевтических инспекций" (P.MM.11.PRC.003), в рамках которой уполномоченные органы представляют в Комиссию сведения о результатах фармацевтических инспекций для включения таких сведений в базу данных о фармацевтических инспекциях.
В случае выявления при проведении фармацевтических инспекций критических несоответствий с целью взаимного оперативного информирования уполномоченных органов выполняется процедура "Уведомление о выявлении критических несоответствий" (P.MM.11.PRC.004), в рамках которой уполномоченный орган уведомляет уполномоченные органы других государств-членов о случаях выявления при проведении фармацевтических инспекций критических несоответствий.
В случае выявления при проведении фармацевтических инспекций критических несоответствий при представлении инспектируемым субъектом плана корректирующих и предупреждающих действий и отчета о его выполнении, а также документальных свидетельств устранения несоответствий или при непредставлении инспектируемым субъектом плана корректирующих и предупреждающих действий, отчета о его выполнении и данных, свидетельствующих об устранении выявленных несоответствий, в установленный Правилами проведения инспекций срок выполняются следующие процедуры:
"Уведомление о результатах устранения выявленных критических несоответствий" (P.MM.11.PRC.006), в рамках которой уполномоченный орган, выявивший при проведении фармацевтической инспекции критические несоответствия, уведомляет уполномоченные органы других государств-членов о результатах устранения инспектируемым субъектом таких выявленных критических несоответствий в установленный Правилами проведения инспекций срок;
"Представление в Комиссию сведений о результатах устранения выявленных критических несоответствий" (P.MM.11.PRC.005), в рамках которой уполномоченный орган, выявивший при проведении фармацевтической инспекции критические несоответствия, представляет в Комиссию сведения о результатах устранения инспектируемым субъектом указанных несоответствий в установленный Правилами проведения инспекций срок для включения таких сведений в базу данных о фармацевтических инспекциях с целью актуализации сведений о результатах соответствующей фармацевтической инспекции, ранее представленных в рамках процедуры "Представление в Комиссию сведений о результатах фармацевтических инспекций" (P.MM.11.PRC.003).
В случае выдачи уполномоченным органом по результатам инспекции сертификата выполняется процедура "Представление в Комиссию сведений о выданном по результатам фармацевтической инспекции сертификате" (P.MM.11.PRC.007), в рамках которой уполномоченные органы представляют в Комиссию сведения сертификатах для включения в базу данных о фармацевтических инспекциях и опубликования Комиссией общедоступных сведений о сертификатах на информационном портале Союза.
В случае внесения изменений, приостановления, возобновления или прекращения действия сертификата в порядке, установленном Правилами проведения инспекций, выполняется процедура "Представление в Комиссию измененных сведений о сертификате" (P.MM.11.PRC.008), в рамках которой уполномоченные органы представляют в Комиссию соответствующие сведения о внесении изменений, приостановлении, возобновлении или прекращении действия сертификата для включения и актуализации таких сведений в базе данных о фармацевтических инспекциях, а также для актуализации опубликованных Комиссией общедоступных сведений о сертификатах на информационном портале Союза.
С целью обеспечения беспрепятственного доступа к актуальным сведениям из базы данных о фармацевтических инспекциях в рамках группы процедур обмена сведениями о планах (графиках), результатах фармацевтических инспекций и сертификатах Комиссия обеспечивает опубликование на информационном портале Союза общедоступных сведений из базы данных о фармацевтических инспекциях, включающих сведения о планах (графиках) проведения инспекций и сертификатах, в том числе в машиночитаемом виде, а также обеспечивает посредством веб-интерфейса информационного портала Союза или его сервисов функции поиска, получения и обработки таких сведений. Средствами веб-интерфейса информационного портала Союза обеспечивается возможность выбора и определения параметров поиска, просмотра и (или) выгрузки опубликованных общедоступных сведений в определенных форматах, в том числе по запросу информационных систем заинтересованных лиц, для автоматической обработки сведений, в том числе с учетом истории изменения таких сведений.
Представление сведений осуществляется в соответствии с Регламентом информационного взаимодействия между уполномоченными органами (организациями) государств - членов Евразийского экономического союза в сфере обращения лекарственных средств, проводящими фармацевтические инспекции, и Евразийской экономической комиссией при реализации средствами интегрированной информационной системы Евразийского экономического союза общего процесса "Обмен сведениями о результатах инспектирования производственных площадок производителей лекарственных средств на соответствие требованиям Правил надлежащей производственной практики Евразийского экономического союза", Регламентом информационного взаимодействия между уполномоченными органами (организациями) государств - членов Евразийского экономического союза в сфере обращения лекарственных средств, проводящими фармацевтические инспекции, при реализации средствами интегрированной информационной системы Евразийского экономического союза общего процесса "Обмен сведениями о результатах инспектирования производственных площадок производителей лекарственных средств на соответствие требованиям Правил надлежащей производственной практики Евразийского экономического союза" и Регламентом информационного взаимодействия между органами государственной власти государств - членов Евразийского экономического союза, уполномоченными на осуществление и (или) координацию деятельности в сфере обращения лекарственных средств и заинтересованными в получении сведений о результатах фармацевтических инспекций для реализации возложенных на них полномочий, и Евразийской экономической комиссией при реализации средствами интегрированной информационной системы Евразийского экономического союза общего процесса "Обмен сведениями о результатах инспектирования производственных площадок производителей лекарственных средств на соответствие требованиям Правил надлежащей производственной практики Евразийского экономического союза", утвержденными Решением Коллегии Комиссии от 19 декабря 2023 г. N 178 (далее соответственно - Регламент информационного взаимодействия между уполномоченными органами и Комиссией, Регламент информационного взаимодействия между уполномоченными органами, Регламент информационного взаимодействия между заинтересованными органами и Комиссией).
Формат и структура представляемых сведений должны соответствовать Описанию форматов и структур электронных документов и сведений, используемых для реализации средствами интегрированной информационной системы Евразийского экономического союза общего процесса "Обмен сведениями о результатах инспектирования производственных площадок производителей лекарственных средств на соответствие требованиям Правил надлежащей производственной практики Евразийского экономического союза", утвержденному Решением Коллегии Комиссии от 19 декабря 2023 г. N 178 (далее - Описание форматов и структур электронных документов и сведений).
16. Приведенное описание группы процедур обмена сведениями о планах (графиках), результатах фармацевтических инспекций и сертификатах представлено на рисунке 2.
Рис. 2. Общая схема группы процедур обмена
сведениями о планах (графиках), результатах фармацевтических
инспекций и сертификатах
17. Перечень процедур общего процесса, входящих в группу процедур обмена сведениями о планах (графиках), результатах фармацевтических инспекций и сертификатах, приведен в таблице 2.
Перечень процедур общего процесса, входящих в группу
процедур обмена сведениями о планах (графиках), результатах
фармацевтических инспекций и сертификатах
|
представление в Комиссию сведений о планах (графиках) проведения инспекций |
предназначена для представления уполномоченным органом в Комиссию сведений о плане (графике) проведения инспекций для включения таких сведений в базу данных о фармацевтических инспекциях |
|
|
представление в Комиссию сведений о внесении изменений в план (график) проведения инспекций |
предназначена для представления уполномоченным органом в Комиссию сведений о внесении изменений в план (график) проведения инспекций, сведения о котором были ранее включены в базу данных о фармацевтических инспекциях и опубликованы на информационном портале Союза |
|
|
представление в Комиссию сведений о результатах фармацевтических инспекций |
предназначена для представления уполномоченным органом в Комиссию сведений о результатах фармацевтических инспекций для включения таких сведений в базу данных о фармацевтических инспекциях |
|
|
предназначена для представления уполномоченным органом в уполномоченные органы других государств-членов (уведомляемые органы) сведений о выявлении при проведении фармацевтической инспекции критических несоответствий |
||
|
представление в Комиссию сведений о результатах устранения выявленных критических несоответствий |
предназначена для представления уполномоченным органом в Комиссию сведений об устранении или неустранении инспектируемым субъектом в установленный Правилами проведения инспекций срок выявленных при проведении фармацевтической инспекции критических несоответствий для включения таких сведений в базу данных о фармацевтических инспекциях |
|
|
уведомление о результатах устранения выявленных критических несоответствий |
предназначена для представления уполномоченным органом в уполномоченные органы других государств-членов (уведомляемые органы) сведений об устранении или неустранении инспектируемым субъектом в установленный Правилами проведения инспекций срок выявленных при проведении фармацевтической инспекции критических несоответствий |
|
|
представление в Комиссию сведений о выданном по результатам фармацевтической инспекции сертификате |
предназначена для представления уполномоченным органом в Комиссию сведений о выданном сертификате для включения таких сведений в базу данных о фармацевтических инспекциях |
|
|
предназначена для представления уполномоченным органом в Комиссию сведений о внесении изменений, приостановлении, возобновлении или прекращении действия сертификата (далее - измененные сведения о сертификате) для включения таких сведений в базу данных о фармацевтических инспекциях |
- Гражданский кодекс (ГК РФ)
- Жилищный кодекс (ЖК РФ)
- Налоговый кодекс (НК РФ)
- Трудовой кодекс (ТК РФ)
- Уголовный кодекс (УК РФ)
- Бюджетный кодекс (БК РФ)
- Арбитражный процессуальный кодекс
- Конституция РФ
- Земельный кодекс (ЗК РФ)
- Лесной кодекс (ЛК РФ)
- Семейный кодекс (СК РФ)
- Уголовно-исполнительный кодекс
- Уголовно-процессуальный кодекс
- Производственный календарь на 2025 год
- МРОТ 2025
- ФЗ «О банкротстве»
- О защите прав потребителей (ЗОЗПП)
- Об исполнительном производстве
- О персональных данных
- О налогах на имущество физических лиц
- О средствах массовой информации
- Производственный календарь на 2026 год
- Федеральный закон "О полиции" N 3-ФЗ
- Расходы организации ПБУ 10/99
- Минимальный размер оплаты труда (МРОТ)
- Календарь бухгалтера на 2025 год
- Частичная мобилизация: обзор новостей
- Постановление Правительства РФ N 1875