|
ННИОТ
|
|
DOR
[98, 110, 117, 157 - 160]
|
Категория действия на плод по FDA - N.
Безопасность и эффективность применения DOR при беременности изучены недостаточно.
Нет данных об уровне проникновения DOR через плаценту, но исследования на животных показали, что DOR проникает через плаценту.
Недостаточно данных для оценки тератогенности у человека. Нет доказательства тератогенности у крыс и кроликов.
Нет исследований ПК при беременности у человека.
Противопоказано применение DOR во время беременности.
|
|
EFV
[98, 104, 110, 117, 157 - 160]
|
Категория действия на плод по FDA - D.
Средний уровень проникновения через плаценту. FDA рекомендует женщинам избегать беременности при приеме EFV и не принимать EFV в течение первого триместра беременности, поскольку это может привести к ДНТ плода. В случае беременности применение EFV допустимо только в тех случаях, когда его возможная польза оправдывает потенциальный риск для плода. EFV следует продолжать беременным, которые находятся на эффективной схеме с EFV.
ПК снижается в третьем триместре беременности по сравнению с послеродовым периодом.
|
|
ETR
[98, 110, 117, 157 - 160, 169]
|
Категория действия на плод по FDA - B.
Проникновение через плаценту находится в категориях от умеренных до высоких, в диапазоне от 0,19 до 4,25.
Недостаточно данных для оценки тератогенности у людей.
Нет доказательств тератогенности у крыс или кроликов.
Исследования на животных не выявили прямого или косвенного негативного влияния ETR на течение беременности, внутриутробное развитие, роды и постнатальное развитие.
Клинические данные по применению ETR во время беременности свидетельствуют об отсутствии тератогенного и токсического действия препарата, но крайне ограничены
Данные ПК во время беременности предполагают увеличение экспозиции ETR в 1,2 - 1,6 раза во время беременности.
|
|
NVP
[98, 110, 117, 157 - 160]
|
Категория действия на плод по FDA - B.
Высокий уровень проникновения через плаценту.
Нет доказательств тератогенности у человека.
Безопасность и эффективность NVP, используемого в целях предотвращения передачи ВИЧ-1 от матери к ребенку, установлена в случае применения препарата в составе режима терапии, включавшего однократный прием внутрь дозы 200 мг матерью во время родов.
Существует повышенный риск гепатотоксичности при начале терапии у женщин с числом CD4 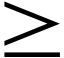 250 мкл-1, ранее не получавших АРТ. Токсическое действие на печень часто сопровождается кожной сыпью и может привести к летальному исходу. Беременность увеличивает этот риск. NVP следует назначать беременным женщинам с числом CD4 250 мкл-1, ранее не получавших АРТ. Токсическое действие на печень часто сопровождается кожной сыпью и может привести к летальному исходу. Беременность увеличивает этот риск. NVP следует назначать беременным женщинам с числом CD4 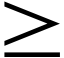 250 мкл-1, только если польза явно превышает риск. Существует потенциальный повышенный риск опасной для жизни гепатотоксичности у женщин с высоким числом CD4. Повышенные уровни трансаминаз на исходном уровне могут увеличить риск токсичности NVP. Женщины, которые забеременели во время приема схем, содержащих NVP, и которые хорошо переносят АРТ, могут продолжать принимать схемы независимо от количества их CD4. 250 мкл-1, только если польза явно превышает риск. Существует потенциальный повышенный риск опасной для жизни гепатотоксичности у женщин с высоким числом CD4. Повышенные уровни трансаминаз на исходном уровне могут увеличить риск токсичности NVP. Женщины, которые забеременели во время приема схем, содержащих NVP, и которые хорошо переносят АРТ, могут продолжать принимать схемы независимо от количества их CD4.
Применение NVP во время беременности показано в случае, если ожидаемая польза для матери превышает потенциальный риск для плода.
ПK существенно не изменяется во время беременности.
|
|
RPV
[98, 110, 117, 157 - 160, 170]
|
Категория действия на плод по FDA - B.
Проникновение через плаценту от умеренного до высокого уровня.
Нет доказательств тератогенности у человека
В исследовании на животных признаков эмбриотоксичности или воздействия на репродуктивную функцию выявлено не было. Небольшое количество данных (от 300 до 1000 исходов беременности) демонстрирует отсутствие врожденных пороков развития плода или фетальной/неонатальной токсичности при применении RPV у беременных женщин. Препарат следует применять во время беременности лишь в том случае, если возможная польза для матери превышает потенциальный риск для плода.
Минимальная концентрация в RPV в плазме крови при беременности на 20 - 50% ниже, чем в послеродовом. Хотя концентрация RPV в плазме снижается во время беременности, дозы, превышающие стандартные, не изучались, и нет достаточных данных, чтобы рекомендовать изменение дозировки во время беременности. Беременным, получающим стандартные дозы, следует контролировать РНК ВИЧ 1 раз в 4 - 8 недель.
|
|
ESV
|
Категория действия на плод по FDA - N.
В настоящее время данных по применению ESV у беременных женщин нет. В доклинических исследованиях признаков эмбриотоксичности и тератогенного действия ESV не обнаружено.
Противопоказано применение ESV во время беременности.
|