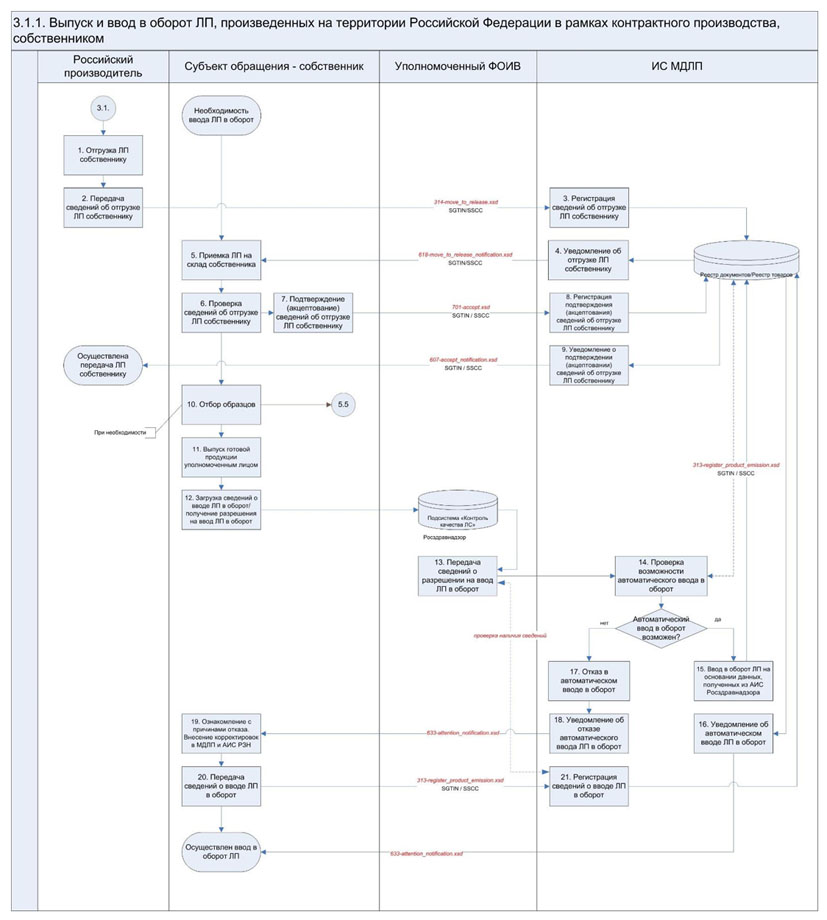
3.1.1. Выпуск и ввод в оборот ЛП, произведенных на территории Российской Федерации в рамках контрактного производства, собственником ЛП
|
В случае, если ввод в оборот ЛП осуществляется собственником ЛП, отличным от российского производителя лекарственных средств, осуществляющего производственную стадию упаковки (фасовки) ЛП во вторичную (потребительскую) упаковку (при ее отсутствии - первичную упаковку), в ИС МДЛП необходимо зарегистрировать операцию передачи ЛП собственнику ЛП. Сведения о передаче ЛП собственнику представляются российским производителем лекарственных средств в ИС МДЛП в течение 5 рабочих дней с даты передачи ЛП. При этом собственником осуществляется подтверждение зарегистрированных российским производителем лекарственных средств сведений в течение 5 рабочих дней с даты приемки ЛП и регистрации в ИС МДЛП сведений о переданных ЛП. В случае необходимости вывода из оборота отобранных образцов ЛП соответствующие сведения регистрируются согласно Разделу 5.5 настоящих Паспортов процессов. Регистрация дальнейших операций по вводу ЛП в оборот осуществляется собственником ЛП. В рамках ввода ЛП в оборот осуществляется автоматизированная передача сведений из АИС Росздравнадзора в ИС МДЛП после представления собственником ЛП документов и сведений, предусмотренных частью 1 статьи 52.1 Федерального закона "Об обращении лекарственных средств", в Росздравнадзор или получения разрешения, предусмотренного частью 7 статьи 52.1 Федерального закона "Об обращении лекарственных средств" (в случае производства иммунобиологических ЛП). В случае успешной регистрации в ИС МДЛП сведений, полученных из АИС Росздравнадзора, разрешается осуществление дальнейших торговых операций с ЛП (оборот ЛП) и дальнейшее отражение действий участниками взаимодействия в ИС МДЛП. В случае отказа ИС МДЛП в автоматическом вводе ЛП в оборот (при наличии оснований для отказа) собственник ЛП осуществляет необходимые проверки и корректировки сведений, содержащихся в АИС Росздравнадзора и (или) ИС МДЛП, и самостоятельно направляет сведения о вводе ЛП в оборот в ИС МДЛП. При необходимости собственником ЛП может осуществляться возврат ЛП, отгруженных ему контрактным производителем. Регистрация в ИС МДЛП сведений о возврате собственником ЛП производителю, осуществившему производственную стадию упаковки (фасовки) в потребительскую упаковку, осуществляется в соответствии с Разделом 3.1.2 настоящих Паспортов процессов. Операции регистрации сведений о вводе ЛП в оборот согласно текущему разделу доступны для субъекта обращения, имеющего лицензию на производство лекарственных средств |
|
|
- российский производитель лекарственных средств - собственник ЛП |
|
|
2. - 3. Регистрация в ИС МДЛП сведений об отгрузке ЛП для выпуска готовой продукции с использованием схемы 314-move_to_release.xsd |
|
|
Перечень передаваемых сведений и владелец информационного ресурса |
При регистрации в ИС МДЛП сведений об отгрузке ЛП собственнику ЛП для выпуска готовой продукции российский производитель лекарственных средств сообщает следующие сведения: - дата совершения операции; - идентификатор места осуществления деятельности российского производителя лекарственных средств, с которого осуществляется отгрузка; - идентификатор места осуществления деятельности собственника ЛП, на которое осуществляется приемка; - дата подтверждающего первичного документа; - номер подтверждающего первичного документа; - SGTIN и/или SSCC |
|
4. Уведомление собственника об отгрузке ЛП для выпуска готовой продукции с использованием схемы 618-move_to_release_notification.xsd |
|
|
Перечень передаваемых сведений и владелец информационного ресурса |
Уведомление собственника об отгрузке ЛП для выпуска готовой продукции формируется на основании ранее зарегистрированной российским производителем лекарственных средств операции и содержит следующие сведения: - дата совершения операции; - идентификатор места осуществления деятельности российского производителя лекарственных средств, с которого осуществляется отгрузка; - идентификатор места осуществления деятельности собственника ЛП, на которое осуществляется приемка; - дата подтверждающего первичного документа; - номер подтверждающего первичного документа; - SGTIN и/или SSCC |
|
6. Осуществление проверки собственником ЛП ранее зарегистрированных российским производителем лекарственных средств сведений об отгрузке ЛП собственнику |
|
|
7. - 8. Подтверждение (акцептование) собственником ЛП сведений об отгрузке ЛП для выпуска готовой продукции с использованием схемы 701-accept.xsd |
|
|
Для осуществления подтверждения (акцептования) ранее зарегистрированных российским производителем лекарственных средств сведений об отгрузке ЛП для выпуска готовой продукции собственник ЛП обеспечивает передачу в ИС МДЛП следующих сведений: - идентификатор места осуществления деятельности собственника ЛП, на которое осуществляется приемка; - идентификатор места осуществления деятельности российского производителя лекарственных средств, с которого осуществляется отгрузка; - дата совершения операции; - SGTIN и/или SSCC |
|
|
9. Уведомление российского производителя лекарственных средств о подтверждении (акцептовании) собственником ЛП сведений об отгрузке ЛП с использованием схемы 607-accept_notification.xsd |
|
|
Уведомление российского производителя лекарственных средств о подтверждении (акцептовании) собственником ЛП сведений об отгрузке ЛП формируется на основании ранее зарегистрированной операции и содержит следующие сведения: - идентификатор места осуществления деятельности собственника ЛП, на которое осуществляется приемка; - идентификатор места осуществления деятельности российского производителя лекарственных средств, с которого осуществляется отгрузка; - дата совершения операции; - SGTIN и/или SSCC |
|
|
11. Выпуск готовой продукции уполномоченным лицом собственника ЛП |
|
|
12. Представление необходимых для ввода в оборот ЛП сведений в Подсистему "Контроль качества лекарственных средств" АИС Росздравнадзора и получение разрешения на ввод в оборот для иммунобиологических ЛП |
|
|
13. Передача из Подсистемы "Контроль качества лекарственных средств" АИС Росздравнадзора сведений, представленных собственником ЛП перед вводом в гражданский оборот, или разрешения на ввод в гражданский оборот иммунобиологического ЛП в ИС МДЛП |
|
|
14. Автоматизированная проверка возможности автоматического ввода ЛП в оборот на основании сведений, полученных из Подсистемы "Контроль качества лекарственных средств" АИС Росздравнадзора |
|
|
15. Автоматический ввод ЛП в оборот и автоматическое формирование схемы 313-register_product_emission.xsd (при отсутствии оснований для отказа) |
|
|
16. Уведомление собственника ЛП об автоматическом вводе ЛП в оборот с использованием схемы 633-attention_notification.xsd |
|
|
17. Отказ ИС МДЛП в автоматическом вводе ЛП в оборот (при наличии оснований для отказа) |
|
|
- отсутствие в ИС МДЛП GTIN и серии ЛП, вводимых в оборот, полученных из АИС Росздравнадзора; - SGTIN имеют статус, отличный от статуса "Ожидает ввода в оборот собственником"; - не внесены сведения в ИС МДЛП об отборе проб/образцов; - количество SGTIN, вводимых в оборот, превышает количество упаковок ЛП, которые вводятся в оборот согласно данным из АИС Росздравнадзора; - SGTIN отсутствуют на балансе у субъекта обращения, сведения о котором поступили из АИС Росздравнадзора; - место осуществления деятельности, на котором находятся SGTIN в момент автоматического ввода в оборот, заблокировано по причине отсутствия действующей лицензии |
|
|
18. Уведомление собственника ЛП об отказе в автоматическом вводе ЛП в оборот с использованием схемы 633-attention_notification.xsd |
|
|
19. Ознакомление с причинами отказа в автоматическом вводе ЛП в оборот, проверка сведений и внесение необходимых корректировок в Подсистеме "Контроль качества лекарственных средств" АИС Росздравнадзора и (или) ИС МДЛП собственником ЛП |
|
|
20. - 21. Регистрация в ИС МДЛП сведений о вводе ЛП в оборот с использованием схемы 313-register_product_emission.xsd |
|
|
Перечень передаваемых сведений и владелец информационного ресурса |
При регистрации в ИС МДЛП операций ввода ЛП в оборот собственником ЛП осуществляется передача следующих сведений: - дата совершения операции; - идентификатор места осуществления деятельности собственника ЛП, осуществляющего регистрацию сведений о завершении выпускающего контроля качества; - дата публикации сведений в Подсистеме "Контроль качества лекарственных средств" АИС Росздравнадзора; - номер решения Росздравнадзора о вводе в гражданский оборот ЛП (только для иммунобиологических ЛП); - внутренний идентификатор записи о вводе ЛП в гражданский оборот в Подсистеме "Контроль качества лекарственных средств" АИС Росздравнадзора; - SGTIN и/или SSCC |
|
Количество упаковок ЛП, в отношении которых регистрируются сведения о вводе в оборот, не должно превышать объем серии, сведения о которой зарегистрированы в АИС Росздравнадзора |
|
- Гражданский кодекс (ГК РФ)
- Жилищный кодекс (ЖК РФ)
- Налоговый кодекс (НК РФ)
- Трудовой кодекс (ТК РФ)
- Уголовный кодекс (УК РФ)
- Бюджетный кодекс (БК РФ)
- Арбитражный процессуальный кодекс
- Конституция РФ
- Земельный кодекс (ЗК РФ)
- Лесной кодекс (ЛК РФ)
- Семейный кодекс (СК РФ)
- Уголовно-исполнительный кодекс
- Уголовно-процессуальный кодекс
- Производственный календарь на 2025 год
- МРОТ 2025
- ФЗ «О банкротстве»
- О защите прав потребителей (ЗОЗПП)
- Об исполнительном производстве
- О персональных данных
- О налогах на имущество физических лиц
- О средствах массовой информации
- Производственный календарь на 2026 год
- Федеральный закон "О полиции" N 3-ФЗ
- Расходы организации ПБУ 10/99
- Минимальный размер оплаты труда (МРОТ)
- Календарь бухгалтера на 2025 год
- Частичная мобилизация: обзор новостей
- Постановление Правительства РФ N 1875