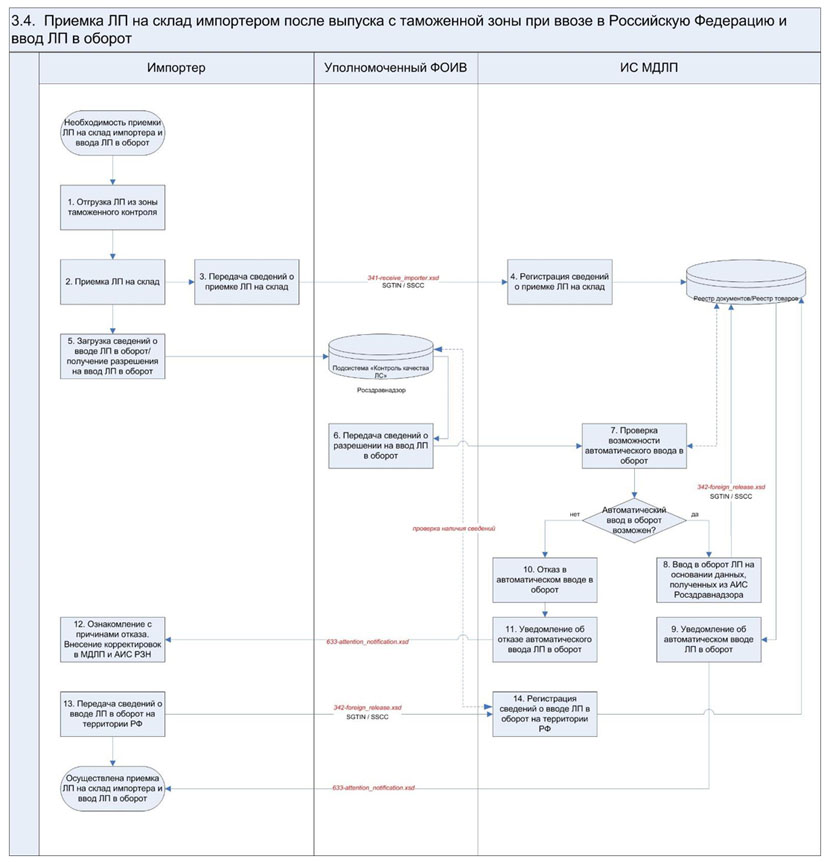
3.4. Приемка ЛП на склад импортером после выпуска с таможенной зоны при ввозе в Российскую Федерацию
|
ЛП, прошедшие процедуру таможенного оформления и выпущенные для внутреннего потребления, размещаются на фармацевтических складах импортера (или логистического оператора). Допускается размещение на фармацевтическом складе импортера условно выпущенных товаров под таможенным контролем. В случае осуществления отборов образов в зоне таможенного контроля и необходимости вывода из оборота отобранных образцов ЛП соответствующие сведения регистрируются согласно Разделу 5.5 настоящих Паспортов процессов. Допускается отгрузка ЛП из зоны таможенного контроля на склад логистического оператора. Сведения об отгрузке ЛП из зоны таможенного контроля на фармацевтический склад представляются субъектом обращения в ИС МДЛП в течение 5 рабочих дней с даты приемки ЛП на фармацевтический склад и завершения таможенной процедуры выпуска товара для внутреннего потребления (или с даты решения о выпуске ЛП для внутреннего потребления, принятого таможенными органами, при применении процедуры условного выпуска товаров). Стоимость ЛП в регистрируемых операциях всегда указывается за единицу товара - вторичную (потребительскую) упаковку ЛП (при ее отсутствии - первичную упаковку ЛП), в том числе в случаях приемки ЛП в третичных (транспортных) упаковках. В рамках ввода ЛП в оборот осуществляется автоматизированная передача сведений из АИС Росздравнадзора в ИС МДЛП после представления импортером документов и сведений, предусмотренных частью 2 статьи 52.1 Федерального закона "Об обращении лекарственных средств", в Росздравнадзор или получения разрешения, предусмотренного частью 7 статьи 52.1 Федерального закона "Об обращении лекарственных средств" (в случае производства иммунобиологических ЛП). В случае успешной регистрации в ИС МДЛП сведений, полученных из АИС Росздравнадзора, разрешается осуществление дальнейших торговых операций с ЛП (оборот ЛП) и дальнейшее отражение действий участниками взаимодействия в ИС МДЛП. В случае отказа ИС МДЛП в автоматическом вводе ЛП в оборот (при наличии оснований для отказа) импортер осуществляет необходимые проверки и корректировки сведений, содержащихся в АИС Росздравнадзора и (или) ИС МДЛП, и самостоятельно направляет сведения о вводе ЛП в оборот в ИС МДЛП. |
|
|
3. - 4. Регистрация в ИС МДЛП сведений о приемке ЛП на склад импортера с использованием схемы 341-receive_importer.xsd |
|
|
Перечень передаваемых сведений и владелец информационного ресурса |
При регистрации в ИС МДЛП результатов приемки ЛП на склад импортер обеспечивает передачу следующих сведений: - дата совершения операции; - идентификатор места осуществления деятельности импортера, на которое осуществлена приемка; - идентификатор места нахождения товара в зоне таможенного контроля (с которого осуществлена отгрузка); - дата первичного документа; - номер первичного документа; - стоимость ЛП, руб. (включая таможенные сборы, пошлины и налоги, включая НДС); - сумма НДС, руб. (если не применимо, указывается 0); - SGTIN и/или SSCC. В случае необходимости указания различных цен внутри групповой упаковки импортер сообщает дополнительно следующие сведения для SSCC: - GTIN; - номер производственной серии; - стоимость ЛП, руб. (для указанных GTIN и номера серии, включая таможенные сборы, пошлины и налоги, включая НДС); - сумма НДС, руб. (если применимо) |
|
5. Представление необходимых для ввода в оборот ЛП сведений в Подсистему "Контроль качества лекарственных средств" АИС Росздравнадзора и получение разрешения на ввод в оборот для иммунобиологических ЛП |
|
|
6. Передача из Подсистемы "Контроль качества лекарственных средств" АИС Росздравнадзора сведений, представленных импортером перед вводом в гражданский оборот, или разрешения на ввод в гражданский оборот иммунобиологического ЛП в ИС МДЛП |
|
|
7. Автоматизированная проверка возможности автоматического ввода ЛП в оборот на основании сведений, полученных из Подсистемы "Контроль качества лекарственных средств" АИС Росздравнадзора |
|
|
8. Автоматический ввод ЛП в оборот и автоматическое формирование схемы 342-release_in_circulation.xsd (при отсутствии оснований для отказа) |
|
|
9. Уведомление импортера об автоматическом вводе ЛП в оборот с использованием схемы 633-attention notification.xsd |
|
|
10. Отказ ИС МДЛП в автоматическом вводе ЛП в оборот (при наличии оснований для отказа) |
|
|
- отсутствие в ИС МДЛП GTIN, серии и номера декларации на товары в отношении ЛП, вводимых в оборот, полученных из АИС Росздравнадзора; - несовпадение номера декларации на товары, указанной субъектом обращения в схеме 335-fts_data.xsd, с номером декларации на товары, полученной от ФТС России; - несовпадение количества ЛП, полученного от ФТС России в рамках сведений о выпуске товаров для внутреннего потребления, с количеством SGTIN, указанных субъектом обращения в схеме 335-fts_data.xsd; - количество SGTIN, вводимых в оборот, превышает количество упаковок ЛП, которые вводятся в оборот согласно данным из АИС Росздравнадзора; - в отношении SGTIN в период с момента получения сведений из АИС Росздравнадзора о вводе в оборот до момента направления субъекту обращения уведомления с использованием схемы 633-attention notification.xsd таким субъектом обращения были поданы иные документы, содержащие сведения о данных SGTIN в ИС МДЛП - SGTIN отсутствуют на балансе у субъекта обращения, сведения о котором поступили из АИС Росздравнадзора; - место осуществления деятельности, на котором находятся SGTIN в момент автоматического ввода в оборот, заблокировано по причине отсутствия действующей лицензии; - SGTIN имеют статус, отличный от статуса "Принят на склад из ЗТК"; - SGTIN имеют вложенность в более чем 2 уровня |
|
|
11. Уведомление импортера об отказе в автоматическом вводе ЛП в оборот с использованием схемы 633-attention notification.xsd |
|
|
12. Ознакомление с причинами отказа в автоматическом вводе ЛП в оборот, проверка сведений и внесение необходимых корректировок в Подсистеме "Контроль качества лекарственных средств" АИС Росздравнадзора и (или) ИС МДЛП импортером |
|
|
13. - 14. Регистрация в ИС МДЛП сведений о вводе ЛП в оборот на территории Российской Федерации с использованием схемы 342-release in circulation.xsd |
|
|
Перечень передаваемых сведений и владелец информационного ресурса |
При регистрации в ИС МДЛП сведений о вводе ЛП в оборот на территории Российской Федерации импортер обеспечивает передачу следующих сведений: - дата совершения операции; - идентификатор места осуществления деятельности импортера, на которое осуществлена приемка; - дата публикации сведений в Подсистеме "Контроль качества лекарственных средств" АИС Росздравнадзора; - номер решения Росздравнадзора о вводе в гражданский оборот ЛП (только для иммунобиологических ЛП); - внутренний идентификатор записи о вводе ЛП в гражданский оборот в Подсистеме "Контроль качества лекарственных средств" АИС Росздравнадзора; - SGTIN и/или SSCC |
|
Количество упаковок ЛП, в отношении которых регистрируются сведения о вводе в оборот на территории Российской Федерации, не должно превышать объем партии ввозимого ЛП, сведения о которой зарегистрированы в АИС Росздравнадзора |
|
- Гражданский кодекс (ГК РФ)
- Жилищный кодекс (ЖК РФ)
- Налоговый кодекс (НК РФ)
- Трудовой кодекс (ТК РФ)
- Уголовный кодекс (УК РФ)
- Бюджетный кодекс (БК РФ)
- Арбитражный процессуальный кодекс
- Конституция РФ
- Земельный кодекс (ЗК РФ)
- Лесной кодекс (ЛК РФ)
- Семейный кодекс (СК РФ)
- Уголовно-исполнительный кодекс
- Уголовно-процессуальный кодекс
- Производственный календарь на 2025 год
- МРОТ 2025
- ФЗ «О банкротстве»
- О защите прав потребителей (ЗОЗПП)
- Об исполнительном производстве
- О персональных данных
- О налогах на имущество физических лиц
- О средствах массовой информации
- Производственный календарь на 2026 год
- Федеральный закон "О полиции" N 3-ФЗ
- Расходы организации ПБУ 10/99
- Минимальный размер оплаты труда (МРОТ)
- Календарь бухгалтера на 2025 год
- Частичная мобилизация: обзор новостей
- Постановление Правительства РФ N 1875