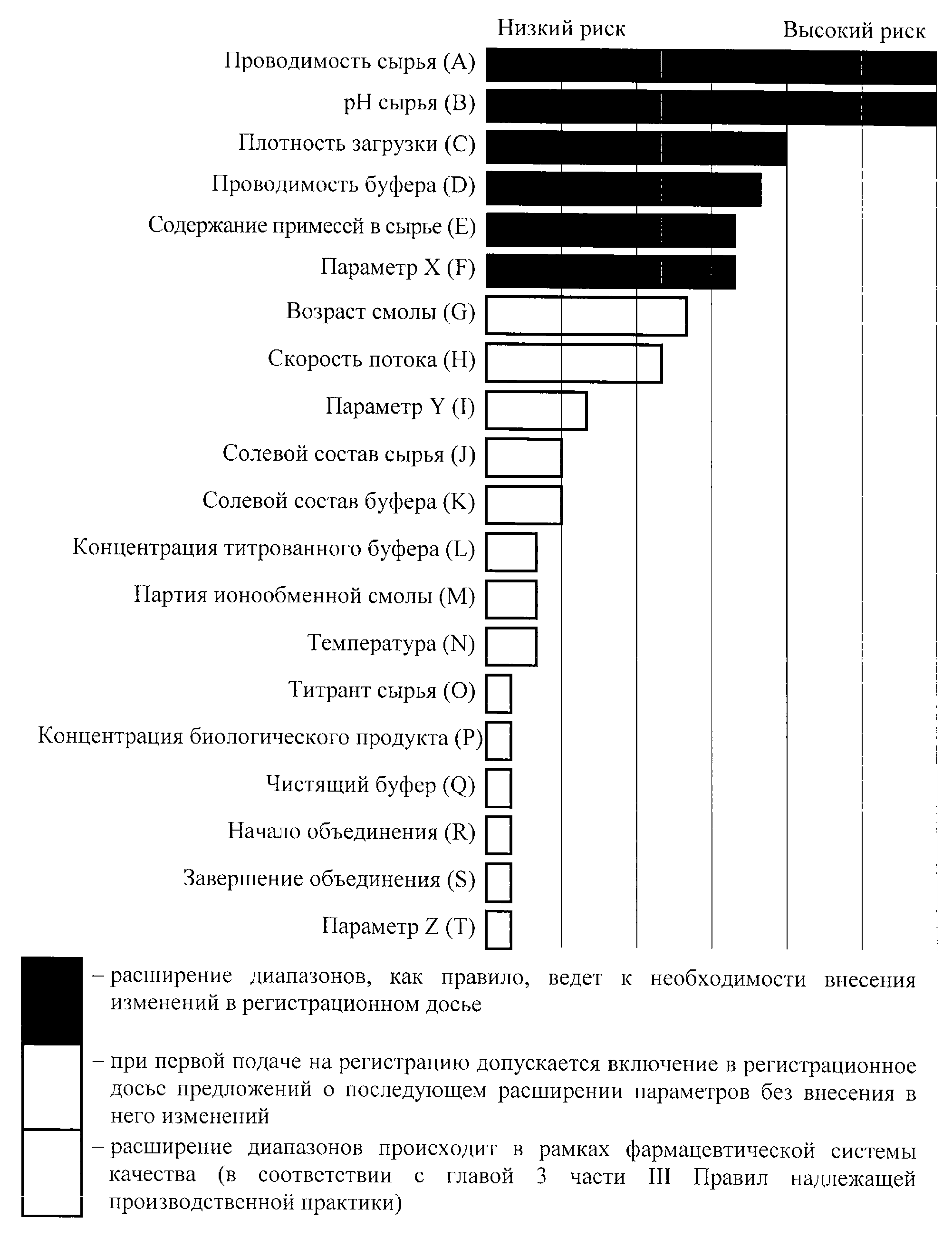
Варианты управления жизненным циклом активной фармацевтической субстанции
По мере улучшения понимания процесса на протяжении жизненного цикла лекарственного препарата следует заново оценивать риски для качества. Указания по управлению жизненным циклом лекарственного препарата содержатся в фармацевтической системе качества, описанной в главе 3 части III Правил надлежащей производственной практики.
Работа в пределах проектного поля не рассматривается в качестве изменения. Выход за пределы проектного поля рассматривается в качестве изменения, поэтому любое расширение диапазонов для параметров с высоким риском (то есть параметров A - F) вне проектного поля, как правило, служит причиной внесения изменений в регистрационное досье лекарственного препарата.
Заявитель вправе включить в исходное регистрационное досье лекарственного препарата при его первой подаче предложение по управлению определенными будущими изменениями параметров G, H и I на протяжении жизненного цикла лекарственного препарата. Вопрос о расширении диапазонов для параметров с низким риском (J - T) решается преимущественно через фармацевтическую систему качества и не требует одобрения уполномоченного органа (экспертной организации) государства-члена, однако должны приниматься во внимание положения приложения N 19 к Правилам регистрации и экспертизы лекарственных средств для медицинского применения. Если после подачи документов выявляется изменение в ранжировании рисков, в результате чего подобное расширение диапазонов параметра начинает представлять повышенный риск, такое изменение следует надлежащим образом отразить в регистрационном досье лекарственного препарата и представить в уполномоченный орган (экспертную организацию) государства-члена.
Рисунок 4. Ранжирование рисков для параметров процесса
ионной хроматографии
- Гражданский кодекс (ГК РФ)
- Жилищный кодекс (ЖК РФ)
- Налоговый кодекс (НК РФ)
- Трудовой кодекс (ТК РФ)
- Уголовный кодекс (УК РФ)
- Бюджетный кодекс (БК РФ)
- Арбитражный процессуальный кодекс
- Конституция РФ
- Земельный кодекс (ЗК РФ)
- Лесной кодекс (ЛК РФ)
- Семейный кодекс (СК РФ)
- Уголовно-исполнительный кодекс
- Уголовно-процессуальный кодекс
- Производственный календарь на 2025 год
- МРОТ 2025
- ФЗ «О банкротстве»
- О защите прав потребителей (ЗОЗПП)
- Об исполнительном производстве
- О персональных данных
- О налогах на имущество физических лиц
- О средствах массовой информации
- Производственный календарь на 2026 год
- Федеральный закон "О полиции" N 3-ФЗ
- Расходы организации ПБУ 10/99
- Минимальный размер оплаты труда (МРОТ)
- Календарь бухгалтера на 2025 год
- Частичная мобилизация: обзор новостей
- Постановление Правительства РФ N 1875