Согласно современным представлениям о патогенезе COVID-19 применение препаратов, рекомендуемых для этиотропной терапии, целесообразно начинать в ранние сроки, не позднее 7 - 8 дня от начала болезни (появления первых симптомов).
Перечень возможных к назначению лекарственных препаратов для этиотропной терапии COVID-19 у взрослых приведен в Приложении 5. Рекомендованные схемы лечения в зависимости от тяжести заболевания приведены в Приложениях 8-1, 8-1.1 и 8-2.
В настоящее время следует выделить несколько препаратов, которые могут быть использованы для этиотропного лечения COVID-19: фавипиравир, в частности, фиксированная комбинация с глюконатом цинка, молнупиравир, нирматрелвир + ритонавир, ремдесивир, синтетическая малая интерферирующая рибонуклеиновая кислота (миРНК) [двуцепочечная], энисамия йодид, риамиловир, умифеновир и интерферон-альфа.
Противовирусной активностью в отношении SARS-CoV-2 и других РНК-содержащих вирусов обладает препарат молнупиравир, представляющий собой низкомолекулярное рибонуклеозидное пролекарство N-гидроксицитидина (NHC). После приема молнупиравира NHC фосфорилируется до трифосфата NHC. Трифосфат NHC встраивается в вирусную РНК с помощью РНК-полимеразы, создавая ошибки в вирусном геноме путем включения гуанозина или аденозина в цепь РНК. С каждым циклом репликации вируса мутации накапливаются, что в конечном итоге делает вирус SARS-CoV-2 неинфекционным и неспособным к репликации.
В исследовании 3-й фазы (NCT04575597) с участием 1433 пациентов было установлено, что у пациентов в группе, получавших молнупиравир (n = 716) в дозе 800 мг каждые 12 часов в течение 5 дней, достоверно установлено снижение риска госпитализации или смерти по сравнению с группой плацебо. Препарат продемонстрировал благоприятный профиль безопасности: соотношение пациентов, которые имели хотя бы одно нежелательное явление, было сходным в двух группах (30,4% в группе молнупиравира и 33,0% в группе плацебо).
В Российской Федерации молнупиравир зарегистрирован для лечения новой коронавирусной инфекции (COVID-19) легкого или среднетяжелого течения у взрослых, в том числе с повышенным риском прогрессирования заболевания до тяжелого течения и не требующих дополнительной оксигенотерапии. Лечение молнупиравиром должно быть начато как можно раньше после постановки диагноза новой коронавирусной инфекции (COVID-19) и/или в течение 5 дней после появления первых симптомов заболевания.
Принимая во внимание сходство клинической симптоматики легких форм COVID-19 с таковой, характерной для сезонных ОРВИ, для предотвращения риска перехода заболевания в более тяжелое течение, пациентам с начальными симптомами ОРВИ, особенно при подозрении или при наличии контактов с больными с подтвержденным COVID-19, рекомендуется до подтверждения этиологического диагноза и на основании клинической картины включать в схемы терапии препараты на основе молекул с прямым противовирусным действием в отношении вирусной РНК-полимеразы (молнупиравир, фавипиравир). При назначении необходимо учитывать эпидемиологический анамнез, тяжесть течения ранее перенесенного COVID-19 (если применимо) и соотношение польза/риск для пациента.
Для лечения пациентов с COVID-19 может применяться препарат нирматрелвир + ритонавир (в таблетках). В основе механизма действия препарата нирматрелвир + ритонавир лежит блокирование активности протеазы SARS-CoV-2-3CL и предотвращение репликации вируса. Ритонавир выступает в качестве фармакокинетического бустера, помогает замедлить метаболизм или распад нирматрелвира с целью сохранения его активности в течение более длительного времени и в более высоких концентрациях.
Финальные данные клинического исследования фазы 2/3 у пациентов высокого риска показали, что препарат нирматрелвир + ритонавир (в таблетках) снижает риск госпитализации и смерти на 89% (в течение 3 дней от появления симптомов) и на 88% (в течение 5 дней от появления симптомов) по сравнению с плацебо. Не было зарегистрировано случаев смерти по сравнению с плацебо у не госпитализированных пациентов высокого риска с COVID-19. Препарат одобрен для экстренного применения Европейским медицинским агентством и FDA у пациентов с COVID-19 начиная с возраста 12 лет и массой тела не менее 40 кг.
В Российской Федерации нирматрелвир + ритонавир показан для лечения COVID-19 легкого и среднетяжелого течения у взрослых, в том числе с повышенным риском прогрессирования заболевания до более тяжелого течения и не требующих дополнительной оксигенотерапии. Лечение лекарственным препаратом, содержащим нирматрелвир + ритонавир, должно быть начато как можно раньше после постановки диагноза новой коронавирусной инфекции (COVID-19) и/или в течение 5 дней после появления первых симптомов заболевания.
При назначении препарата нирматрелвир + ритонавир необходимо учитывать возможные лекарственные взаимодействия (Приложение 4). Ритонавир является ингибитором фермента CYP3A и может повышать концентрации лекарственных средств, чем основной путь метаболизма зависит от цитохрома CYP3A.
Препарат фавипиравир - синтетический противовирусный препарат, селективный ингибитор РНК-полимеразы, активный в отношении РНК-содержащих вирусов. В Российской Федерации зарегистрированы препараты на основе фавипиравира для приема внутрь (в таблетированной форме), в том числе, фиксированная комбинация фавипиравира с глюконатом цинка, и для парентерального применения (лиофилизат для приготовления концентрата для приготовления раствора для инфузий; концентрат для приготовления раствора для инфузий; порошок для приготовления концентрата для приготовления раствора для инфузий). Фавипиравир в таблетированной форме может применяться как в амбулаторных, так и в стационарных условиях.
В Российских и международных исследованиях показано, что применение фавипиравира ускоряет элиминацию вируса и достижение клинического улучшения. При этом улучшение по данным КТ ОГК через 14 дней после окончания исследуемой терапии зафиксировано у 91,4% пациентов в группе фавипиравира и только у 62,2% пациентов в контрольной группе.
Применение фиксированной комбинации фавипиравира и цинка (в виде цинка глюконата) приводит к расширению фармакодинамического потенциала за счет дополнительных эффектов образуемого координационного комплекса, что обеспечивает прямое противовирусное и противовоспалительное действие, поддерживает защитные свойства организма, повышает терапевтическую эффективность препарата. В сравнительном клиническом исследовании эффективности и безопасности комбинированного препарата на основе фавипиравира с цинком у пациентов с новой коронавирусной инфекцией (COVID-19) было показано, что курс терапии препаратом продолжительностью 5 дней обеспечивает значимое снижение частоты прогрессирования COVID-19 до тяжелого течения и ускоряет выздоровление. Терапия характеризовалась благоприятным профилем безопасности.
Фавипиравир в формах для парентерального применения может использоваться в стационарных условиях. В клинических исследованиях был продемонстрирован благоприятный профиль безопасности фавипиравира для парентерального введения (частота нежелательных явлений у пациентов, получавших фавипиравир в клинических исследованиях, не отличалась от таковой в группе стандартной терапии) и высокая эффективность в отношении улучшения клинического статуса, в том числе у пациентов имеющих высокий риск тяжелого течения заболевания: пациенты старше 65 лет, пациенты с сопутствующими заболеваниями (сахарный диабет, ожирение, хронические заболевания сердечно-сосудистой системы). В клиническом исследовании применения фавипиравира в форме концентрат для приготовления раствора для инфузий у 320 пациентов с COVID-19 среднетяжелого и тяжелого течения была показана высокая эффективность препарата в отношении элиминации вируса, улучшения состояния легких по данным КТ ОГК, достижения клинического выздоровления, а также показаны преимущества в отношении улучшения клинического статуса пациентов по сравнению с терапией сравнения (ремдесивир).
Противовирусной активностью в отношении SARS-CoV-2 обладает ремдесивир. Его активный метаболит выступает в качестве аналога аденозинтрифосфата (АТФ) и конкурирует с природным АТФ-субстратом за включение в формирующиеся РНК-цепи с помощью РНК-зависимой РНК-полимеразы вируса SARS-CoV-2, что приводит к задержанному обрыву цепи во время репликации вирусной РНК. Применение препарата возможно только в медицинской организации, оказывающей медицинскую помощь в стационарных условиях. Учитывая благоприятный профиль безопасности препарата (частота нежелательных явлений у пациентов, получавших ремдесивир в клинических исследованиях, не отличалась от таковой в группе стандартной терапии), а также данные по его эффективности, ремдесивир может рассматриваться как препарат выбора для пациентов с повышенной активностью трансаминаз на начало лечения.
Синтетическая малая интерферирующая рибонуклеиновая кислота (миРНК) [двуцепочечная] представляет собой комбинированное лекарственное средство, обладающее противовирусным эффектом в отношении SARS-CoV-2. Противовирусное действие миРНК основано на механизме РНК-интерференции и включает специфическое распознавание геномных мишеней вируса с последующим привлечением собственных белковых комплексов клетки, разрушающих вирусный геном (и его мРНК-транскрипты) и тем самым нарушающих процесс репликации вируса. Как известно, развитие симптомов и осложнений новой коронавирусной инфекции возникают спустя несколько дней после начала болезни.
Как правило, дебют заболевания пациенты переживают в домашних условиях и направляются на госпитализацию в результате ухудшения состояния ввиду отсутствия терапии или недостаточности назначенной схемы лечения. Наиболее рационально использовать препарат синтетической малой интерферирующей рибонуклеиновой кислоты (миРНК) [двуцепочечной] в амбулаторных условиях на ранней стадии заболевания с целью скорейшего купирования симптомов и минимизации риска развития осложнений и последующей госпитализации.
Согласно инструкции по медицинскому применению синтетическая малая интерферирующая рибонуклеиновая кислота (миРНК) [двуцепочечная] применяется ингаляционно с помощью меш-небулайзера. Препарат назначается в условиях стационара или амбулаторно. При легкой степени тяжести COVID-19 препарат применяют 3 раза в день с перерывом между ингаляциями 6 - 7 часов. Разовая доза составляет 1,85 мг, суточная - 5,55 мг/сут. Курс лечения составляет до 7 дней (до 21 ингаляции). При среднетяжелой степени препарат применяется ингаляционно с помощью меш-небулайзера в стационарных условиях в два приема с перерывом 7 - 8 часов. Разовая доза составляет 1,85 мг, суточная - 3,7 мг. Курс лечения - 14 дней (28 ингаляций). Препарат противопоказан при повышенной чувствительности к действующему веществу или любому другому компоненту препарата и в связи с отсутствием данных об эффективности и безопасности - при тяжелом течении COVID-19, возрасте младше 18 и старше 65 лет, беременности и в периоде грудного вскармливания, при применении системных ГКС на постоянной основе.
Вируснейтрализующим действием в отношении SARS-CoV-2 потенциально обладают искусственные моноклональные антитела (МКА). Рекомбинантные МКА человека класса IgGl, связываясь с неперекрывающимися эпитопами рецептор-связывающего домена S-белка, блокируют взаимодействие S-белка SARS-CoV-2 с ангиотензин-превращающим ферментом 2 (АПФ2), что приводит к подавлению инфицирования клеток хозяина и останавливает репликацию вируса. Ранее в клинической практике использовались однокомпонентные (сотровимаб, регданвимаб), а также комбинированные (бамланивимаб + этесевимаб <1>; касиривимаб + имдевимаб, тиксагевимаб + цилгавимаб) препараты. Данные вируснейтрализующие МКА являются высокоэффективными препаратами и обычно используются для лечения и профилактики COVID-19 в группах риска тяжелого течения заболевания. Однако они высокоселективны в отношении определенных штаммов вируса и при изменении поверхностного S-белка вируса в результате мутаций легко теряют свои вируснейтрализующие свойства. В настоящее время все вышеперечисленные МКА являются не эффективными в отношении циркулирующих в Российской Федерации и в мире штаммов SARS-CoV-2.
Умифеновир относится к ингибиторам слияния (фузии), взаимодействует с гемагглютинином вируса и препятствует слиянию липидной оболочки вируса и клеточных мембран.
Имидазолилэтанамид пентандиовой кислоты на уровне инфицированных клеток активирует факторы врожденного иммунитета, подавляемых вирусными белками; подавляет продукцию ключевых провоспалительных цитокинов (фактора некроза опухоли  , интерлейкинов (
, интерлейкинов (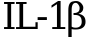 и IL-6)), снижением активности миелопероксидазы.
и IL-6)), снижением активности миелопероксидазы.
Рекомбинантный интерферон альфа 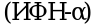 для интраназального введения обладает иммуномодулирующим, противовоспалительным и противовирусным действием. Механизм действия основан на предотвращении репликации вирусов, попадающих в организм через дыхательные пути.
для интраназального введения обладает иммуномодулирующим, противовоспалительным и противовирусным действием. Механизм действия основан на предотвращении репликации вирусов, попадающих в организм через дыхательные пути.
Этиотропное лечение COVID-19, особенно у больных с сопутствующей патологией, требует внимания к возможным лекарственным взаимодействиям. Лекарственные препараты, которые запрещено или нежелательно принимать с этиотропной терапией COVID-19, можно найти на сайте https://www.covid19-druginteractions.org/. Лекарственные взаимодействия антитромботических и препаратов для лечения пациентов с COVID-19 указаны в Приложении 4.
Принимая во внимание сходство клинической картины легких форм COVID-19 с клинической картиной сезонных ОРВИ, до подтверждения этиологического диагноза в схемы терапии следует включать препараты, рекомендованные для лечения сезонных ОРВИ в соответствии Клиническими рекомендациями "Острые респираторные вирусные инфекции (ОРВИ) у взрослых", одобренные Минздравом России.
Согласно рекомендациям ВОЗ возможно назначение препаратов с предполагаемой этиотропной эффективностью "off-label" (то есть применение с медицинской целью не соответствует инструкции по медицинскому применению), при этом их назначение должно соответствовать этическим нормам, рекомендованным ВОЗ, и осуществляться на основании: Федерального закона от 21 ноября 2011 г. N 323-ФЗ "Об основах охраны здоровья граждан в Российской Федерации", Федерального закона от 12 апреля 2010 г. N 61-ФЗ "Об обращении лекарственных средств", Национального стандарта Российской Федерации ГОСТ Р ИСО 14155-2014 "Надлежащая клиническая практика", приказа Министерства здравоохранения Российской Федерации от 1 апреля 2016 г. N 200н "Об утверждении правил надлежащей клинической практики" (зарегистрирован Министерством юстиции Российской Федерации 23 августа 2016 г., регистрационный N 43357), Хельсинкской декларации Всемирной медицинской ассоциации (ВМА) об этических принципах проведения исследований с участием человека в качестве субъекта, декларированных на 64-ой Генеральной ассамблее ВМА, Форталеза, Бразилия, 2013 г.
Информация о случаях побочных действий, не указанных в инструкции по применению лекарственных препаратов, о серьезных нежелательных реакциях, непредвиденных нежелательных реакциях при применении лекарственных препаратов, об особенностях взаимодействия лекарственных препаратов с другими лекарственными препаратами должна собираться и передаваться в установленном порядке в Росздравнадзор.
- Гражданский кодекс (ГК РФ)
- Жилищный кодекс (ЖК РФ)
- Налоговый кодекс (НК РФ)
- Трудовой кодекс (ТК РФ)
- Уголовный кодекс (УК РФ)
- Бюджетный кодекс (БК РФ)
- Арбитражный процессуальный кодекс
- Конституция РФ
- Земельный кодекс (ЗК РФ)
- Лесной кодекс (ЛК РФ)
- Семейный кодекс (СК РФ)
- Уголовно-исполнительный кодекс
- Уголовно-процессуальный кодекс
- Производственный календарь на 2025 год
- МРОТ 2026
- ФЗ «О банкротстве»
- О защите прав потребителей (ЗОЗПП)
- Об исполнительном производстве
- О персональных данных
- О налогах на имущество физических лиц
- О средствах массовой информации
- Производственный календарь на 2026 год
- Федеральный закон "О полиции" N 3-ФЗ
- Расходы организации ПБУ 10/99
- Минимальный размер оплаты труда (МРОТ)
- Календарь бухгалтера на 2025 год
- Частичная мобилизация: обзор новостей
- Постановление Правительства РФ N 1875