В Российской Федерации для специфической профилактики COVID-19 зарегистрированы следующие вакцины:
- комбинированная векторная вакцина ("Гам-КОВИД-Вак", раствор для внутримышечного введения), дата регистрации 11.08.2020 г.;
- комбинированная векторная вакцина ("Гам-КОВИД-Вак-Лио"), дата регистрации 25.08.2020 г.;
- вакцина на основе пептидных антигенов ("ЭпиВакКорона"), дата регистрации 13.10.2020 г.;
- вакцина коронавирусная инактивированная цельновирионная концентрированная очищенная ("КовиВак"), дата регистрации 19.02.2021 г.;
- однокомпонентная векторная вакцина ("Спутник Лайт"), дата регистрации 06.05.2021 г.;
- вакцина на основе пептидных антигенов ("АВРОРА-КоВ"), дата регистрации 26.08.2021 г., дата переоформления 12.04.2022 г.;
- комбинированная векторная вакцина ("Гам-КОВИД-Вак-М"), дата регистрации 24.11.2021.
- Вакцина субъединичная рекомбинантная ("Конвасэл"), дата регистрации 18.03.2022 г.;
- Комбинированная векторная вакцина ("Гам-КОВИД-Вак", капли назальные), дата регистрации 31.03.2022 г.
- Комбинированная векторная вакцина ("Салнавак"), дата регистрации 04.07.2022 г.
- Комбинированная векторная вакцина ("Гам-КОВИД-Вак-Д"), дата регистрации 14.04.2023 г.
Комбинированная векторная вакцина "Гам-КОВИД-Вак" получена биотехнологическим путем, при котором вирус SARS-CoV-2 не используется. Препарат состоит из двух компонентов: рекомбинантный аденовирусный вектор на основе аденовируса человека 26 серотипа, несущий ген S-белка SARS-CoV-2 (компонент I) и рекомбинантный аденовирусный вектор на основе аденовируса человека 5 серотипа, несущий ген S-белка SARS-CoV-2 (компонент II). Вакцина "Гам-КОВИД-Вак" в форме раствора для внутримышечного введения и в форме назальных капель применяется для профилактики COVID-19 у взрослых старше 18 лет.
Вакцина "Спутник Лайт" представляет собой рекомбинантный аденовирусный вектор на основе аденовируса человека 26 серотипа, несущий ген S-белка SARS-CoV-2 и применяется для профилактики COVID-19 у взрослых старше 18 лет.
Вакцина "Гам-КОВИД-Вак-М" представляет собой рекомбинантный аденовирусный вектор на основе аденовируса человека 26 серотипа, несущий ген S-белка SARS-CoV 2 (с уменьшенным содержанием аденовирусных частиц), и применяется для профилактики COVID-19 у подростков в возрасте от 12 до 17 лет (включительно).
Комбинированная векторная вакцина "Гам-КОВИД-Вак-Д" состоит из двух компонентов: рекомбинантные аденовирусные частицы 26 серотипа, содержащие ген белка S вируса SARS-CoV-2 (компонент I) и рекомбинантные аденовирусные частицы 5 серотипа, содержащие ген белка S вируса SARS-CoV-2 (компонент II). Вакцина "Гам-КОВИД-Вак-Д" предназначена для профилактики COVID-19 у детей в возрасте от 6 до 11 лет (включительно).
Вакцина на основе пептидных антигенов ("ЭпиВакКорона" и "АВРОРА-КоВ") представляет собой химически синтезированные пептидные антигены белка S вируса SARS-CoV-2, конъюгированные с белком-носителем и адсорбированные на алюминий-содержащем адъюванте (алюминия гидроксиде). Вакцина "ЭпиВакКорона" применяется для профилактики COVID-19 у взрослых старше 18 лет, вакцина "АВРОРА-КоВ" - у взрослых в возрасте 18 - 60 лет.
Инактивированная вакцина ("КовиВак") представляет собой очищенную концентрированную суспензию коронавируса SARS-CoV-2 штамм "AYDAR-1", полученного путем репродукции в перевиваемой культуре клеток Vero, инактивированного бета-пропиолактоном. Вакцина хранится при температуре от +2 до +8 °C. Вакцину не замораживать! Вакцину вводят двукратно с интервалом 14 дней в дозе 0,5 мл внутримышечно в верхнюю треть наружной поверхности плеча. Вакцина "КовиВак" применяется для профилактики COVID-19 у взрослых в возрасте 18 - 60 лет.
Вакцина субъединичная рекомбинантная ("Конвасэл") представляет собой рекомбинантный нуклеокапсидный белок вируса SARS-CoV-2, полученный в Escherichia coli, и смесь вспомогательных веществ (сквалан, 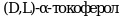 , Полисорбат 80) в форме эмульсии. Применяется для профилактики COVID-19 у взрослых в возрасте 18 - 60 лет.
, Полисорбат 80) в форме эмульсии. Применяется для профилактики COVID-19 у взрослых в возрасте 18 - 60 лет.
Комбинированная векторная вакцина ("Салнавак") в форме спрея назального получена биотехнологическим путем, при котором вирус SARS-CoV-2 не используется. Препарат состоит из двух компонентов: рекомбинантный аденовирусный вектор на основе аденовируса человека 26 серотипа, несущий ген S-белка SARS-CoV-2 (компонент I) и рекомбинантный аденовирусный вектор на основе аденовируса человека 5 серотипа, несущий ген S-белка SARS-CoV-2 (компонент II). Применяется для профилактики COVID-19 у взрослых в возрасте 18 - 60 лет.
В Календаре профилактических прививок по эпидемическим показаниям определены категории граждан подлежащие вакцинации против COVID-19 <1>. В соответствии с Письмом Минздрава России от 18 июня 2024 года N 30-4/2753 "О вакцинации против COVID-19", вакцинопрофилактика в настоящее время носит рекомендательный характер.
--------------------------------
<1> Приказ Министерства здравоохранения Российской Федерации от 06.12.2021 N 1122н "Об утверждении национального календаря профилактических прививок, календаря профилактических прививок по эпидемическим показаниям и порядка проведения профилактических прививок"
Вакцинные препараты (кроме вакцины "Гам-КОВИД-Вак" в форме раствора для внутримышечного введения) зарегистрированы по особой процедуре регистрации, в связи с чем необходимо уведомлять Федеральную службу по надзору в сфере здравоохранения о каждом факте применения лекарственного препарата путем внесения информации в соответствующий раздел информационной системы ЕГИСЗ. Факт применения вакцины на I и II этапах подтверждается внесением информации по форме регистра вакцинированных от COVID-19 в ЕГИСЗ.
При работе с побочными проявлениями после иммунизации вакцин следует учитывать положения "Методические рекомендации по выявлению, расследованию и профилактике побочных проявлений после иммунизации" (утверждены Минздравом России 12.04.2019). В субъектах Российской Федерации предпочтительно создать и утвердить региональные иммунологические комиссии (далее - Комиссия), которые могут быть оперативно привлечены для проведения комиссионного расследования побочных явлений после иммунизации. Акт расследования каждого случая серьезного побочного проявления после иммунизации направляется в Центральный аппарат Росздравнадзора в электронной форме в качестве приложения к извещению о нежелательной реакции на лекарственный препарат информационного ресурса "Фармаконадзор 2.0" Автоматизированной Информационной Системы Росздравнадзора.
У особых групп пациентов (пациенты с первичным и вторичным иммунодефитом; онкологические больные, получающие лучевую терапию, химиотерапию, таргетную терапию или иммунотерапию; пациенты, перенесшие трансплантацию костного мозга или органов; пациенты, получающие лекарственные препараты, ослабляющих иммунитет; пациенты с ожирением (ИМТ >= 35), сердечно-сосудистыми заболеваниями, хроническими заболеваниями легких, сахарным диабетом 1 или 2 типа, хроническими заболеваниями почек) с целью доконтактной (предэкспозиционной) профилактики COVID-19 ранее использовалась комбинация моноклональных антител длительного действия (тиксагевимаб + цилгавимаб): взрослые и дети в возрасте от 12 лет и старше с массой тела не менее 40 кг, которые имели снижение иммунитета вследствие патологического состояния или применения иммуносупрессивных лекарственных препаратов или терапии, или у них отсутствует адекватный иммунный ответ на вакцинацию против COVID-19 или вакцинация имеющейся вакциной от COVID-19 в соответствии с одобренным или утвержденным графиком была не рекомендована им вследствие ранее перенесенной тяжелой нежелательной реакции (например, тяжелая аллергическая реакция) на вакцину(ы) против COVID-19 и/или компонент(ы) вакцины против COVID-19. Однако, в настоящее время данные комбинация моноклональных антител потеряла свою вируснейтрализующую активности в отношении циркулирующих штаммов SARS-CoV-2 и более не используется в клинической практике.
С учетом особенностей вновь появляющихся вариантов вируса был разработан и зарегистрирован 12 декабря 2025 г. Комитетом Европейского агентства лекарственных средств препарат моноклональное антитело длительного действия второго поколения - Сипавибарт (AZD3152; Kavigale). Оценка эффективности и безопасности препарата проводилась в масштабном (3335 участников) международном рандомизированном двойном слепом клиническом исследовании III фазы SUPERNOVA в сравнении с препаратом Эвушелд или плацебо в популяции иммунокомпрометированных пациентов.
При применении Сипавибарта было продемонстрировано снижение риска COVID-19 с клиническими проявлениями на 41,9% (95% ДИ: 22,5; 56,5) в течение 3-месячного периода после внутримышечного введения в дозе 300 мг для всех вариантов SARS-CoV-2. Аналогичным образом, в анализе совпадающих вариантов вируса (не содержащих мутацию F456L) сипавибарт обеспечивал снижение риска на 60,0% (95% ДИ: 26,2; 74,9).
Профилактическая эффективность препарата сохранялась к 6-му месяцу после введения: было продемонстрировано снижение риска COVID-19 с клиническими проявлениями для всех вариантов SARS-CoV-2 на 29,9% (95% ДИ: 13,4, 43,3) и на 35,3% (95% ДИ: 12,7, 52,0) для совпадающих вариантов вируса (без мутации F456L).
В настоящее время препарат не зарегистрирован на территории Российской Федерации.
- Гражданский кодекс (ГК РФ)
- Жилищный кодекс (ЖК РФ)
- Налоговый кодекс (НК РФ)
- Трудовой кодекс (ТК РФ)
- Уголовный кодекс (УК РФ)
- Бюджетный кодекс (БК РФ)
- Арбитражный процессуальный кодекс
- Конституция РФ
- Земельный кодекс (ЗК РФ)
- Лесной кодекс (ЛК РФ)
- Семейный кодекс (СК РФ)
- Уголовно-исполнительный кодекс
- Уголовно-процессуальный кодекс
- Производственный календарь на 2025 год
- МРОТ 2026
- ФЗ «О банкротстве»
- О защите прав потребителей (ЗОЗПП)
- Об исполнительном производстве
- О персональных данных
- О налогах на имущество физических лиц
- О средствах массовой информации
- Производственный календарь на 2026 год
- Федеральный закон "О полиции" N 3-ФЗ
- Расходы организации ПБУ 10/99
- Минимальный размер оплаты труда (МРОТ)
- Календарь бухгалтера на 2025 год
- Частичная мобилизация: обзор новостей
- Постановление Правительства РФ N 1875