Причиной возникновения ГБ Ia типа являются мутации в гене G6PC, кодирующем глюкозо-6-фосфатазу, что приводит к ее недостаточности в печени, почках, слизистой оболочке кишечника, а также в островках 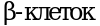 поджелудочной железы и желчного пузыря. Генный локус гликогеновой болезни Ia типа соответствует 17q21.31. Он содержит 5 экзонов и занимает около 12,5 kb геномной ДНК. Тип наследования - аутосомно-рецессивный.
поджелудочной железы и желчного пузыря. Генный локус гликогеновой болезни Ia типа соответствует 17q21.31. Он содержит 5 экзонов и занимает около 12,5 kb геномной ДНК. Тип наследования - аутосомно-рецессивный.
Патогенез ГБ Ia типа. Глюкозо-6-фосфатаза катализирует конечную реакцию как глюконеогенеза, так и гидролиза гликогена, гидролизуя глюкозо-6-фосфат на глюкозу и неорганический фосфат (Pi) и являясь единственным источником обеспечения организма большими концентрациями глюкозы. Неспособность организма больного превратить глюкозо-6-фосфат в глюкозу ведет к гипогликемии даже при кратковременном голодании из-за блокады гликогенолиза и глюконеогенеза и к накоплению гликогена в печени, почках и слизистой оболочке кишечника, приводя к дисфункции этих органов. Накопление субстрата блокированной реакции, глюкозо-6-фосфата, стимулирует гликолиз и накопление лактата, который, синтезируясь в эритроцитах и мышечной ткани, не может быть превращен в глюкозу в печени (блокада глюконеогенеза). Гипогликемия обусловливает относительно низкую концентрацию инсулина. Снижается соотношение инсулин/глюкагон, стимулируя липолиз, и повышается уровень жирных кислот в плазме. Стимуляция гликолиза ведет к увеличению синтеза глицерола и ацетил-КоА, субстратов и кофакторов синтеза триглицеридов в печени. Глюкагон также стимулирует метаболические пути, угнетающие  жирных кислот в митохондриях, что сопровождается дикарбоновой ацидурией. Если скорость синтеза аполипопротеинов и образования липопротеинов очень низкой плотности (ЛПОНП) и липопротеинов низкой плотности (ЛПНП) отстает от ускоренного синтеза липидов, в гепатоцитах образуются капли жира, вызывая выраженную гепатомегалию (жировая трансформация, стеатоз печени). Лактат является конкурентным ингибитором почечно-канальцевой секреции уратов, что ведет к гиперурикемии и гипоурикозурии. Гиперурикемия является следствием не только снижения почечного клиренса, но и гиперпродукции мочевой кислоты в результате истощения внутрипеченочного фосфата и ускоренной деградации адеиновых нуклеотидов.
жирных кислот в митохондриях, что сопровождается дикарбоновой ацидурией. Если скорость синтеза аполипопротеинов и образования липопротеинов очень низкой плотности (ЛПОНП) и липопротеинов низкой плотности (ЛПНП) отстает от ускоренного синтеза липидов, в гепатоцитах образуются капли жира, вызывая выраженную гепатомегалию (жировая трансформация, стеатоз печени). Лактат является конкурентным ингибитором почечно-канальцевой секреции уратов, что ведет к гиперурикемии и гипоурикозурии. Гиперурикемия является следствием не только снижения почечного клиренса, но и гиперпродукции мочевой кислоты в результате истощения внутрипеченочного фосфата и ускоренной деградации адеиновых нуклеотидов.
Механизмы формирования фокально-сегментарного гломерулосклероза при ГБ I типа окончательно не ясны. Не может быть причиной гиперфильтации и характер питания, т.к. в рационе преобладают углеводы. Не исключено, что формирование фокально-сегментарного гломерулосклероза связано также с персистирующей гиперлипидемией, наподобие того, как это происходит при первичном нефротическом синдроме с неадекватным контролем частоты рецидивов и активности болезни. На роль других патогенетических факторов претендуют артериальная гипертензия, нередко возникающая при ГБ I типа, и гиперурикемия. Конкременты чаще состоят из кристаллов моногидрата оксалата кальция, хотя наличие гиперуратурии дает основания ожидать уратного состава камней, но это не так. Механизм образования оксалатно-кальциевых конкрементов при ГБ I типа не изучен. Возможно, к нему имеют отношение хронический ацидоз и урикемия либо энзиматические дефекты в печени с возможной аналогией гипероксалурии типа I.
Причиной возникновения ГБ Ib типа являются мутации гена SLC17A4, кодирующего микросомальный транспортный белок T1 (транслоказу глюкозо-6-фосфатазы), что приводит к ее недостаточности в печени, почках, слизистой оболочке кишечника. Генный локус ГБ Ib соответствует 11q23.3. Он содержит 9 экзонов и занимает от 4 до 5,3 kb геномной ДНК. Тип наследования - аутосомно-рецессивный.
Патогенез ГБ Ib типа. Расположение активного центра глюкозо-6-фосфатазы в просвете ЭПР обусловливает необходимость транспортировки всех субстратов и продуктов реакции, катализируемой ферментом, через мембрану ЭПР. Недостаточность белка T1 сопровождается недостаточностью глюкозо-6-фосфатазы. Специфическим признаком ГБ Ib типа является нейтропения и ухудшение функции нейтрофилов. У таких больных нарушена как двигательная способность нейтрофилов, так и их активность при респираторном взрыве. Кроме того, эти патологические изменения могут быть связаны с нарушением транспорта глюкозы через мембрану полиморфно-ядерных лейкоцитов. Согласно существующим предположениям, микросомальный транспорт глюкозо-6-фосфата играет определенную роль в антиоксидантной защите нейтрофилов, а генетическая поломка транслоказы глюкозо-6-фосфатазы ведет к нарушению клеточных функций, в частности, апоптоза, что может служить объяснением нейтрофильной дисфункции у больных с ГБ Ib типа.
Причиной возникновения ГБ III типа являются мутации гена AGL, кодирующего гликоген-деветвящий фермент, который представляет собой большой мономерный белок с молекулярной массой приблизительно 160 кД и имеет 2 каталитических единицы: амило-1, 6-глюкозидазу и  , способные функционировать независимо друг от друга, однако для нормального действия деветвящего фермента необходима активность обеих каталитических единиц. Подавляющее большинство больных имеют дефицит этого энзима как в печени, так и в мышцах (подтип IIIa), однако примерно у 15% пациентов он отмечается только в печени (подтип IIIb). Наличие указанных подтипов объясняется различной экспрессией фермента в тканях. В редких случаях селективное снижение активности либо амило-1, 6-глюкозидазы, либо
, способные функционировать независимо друг от друга, однако для нормального действия деветвящего фермента необходима активность обеих каталитических единиц. Подавляющее большинство больных имеют дефицит этого энзима как в печени, так и в мышцах (подтип IIIa), однако примерно у 15% пациентов он отмечается только в печени (подтип IIIb). Наличие указанных подтипов объясняется различной экспрессией фермента в тканях. В редких случаях селективное снижение активности либо амило-1, 6-глюкозидазы, либо  приводит к развитию подтипов IIIc и IIId болезни, соответственно. Генный локус ГБ III типа соответствует 1p21.2. Он содержит 35 экзонов, занимающих 85 kb геномной ДНК. Тип наследования - аутосомно-рецессивный.
приводит к развитию подтипов IIIc и IIId болезни, соответственно. Генный локус ГБ III типа соответствует 1p21.2. Он содержит 35 экзонов, занимающих 85 kb геномной ДНК. Тип наследования - аутосомно-рецессивный.
Патогенез ГБ III типа. Амило-1, 6-глюкозидаза участвует в метаболизме гликогена в точках ветвления гликогенового "дерева". Фермент является бифункциональным, с одной стороны превращая лимит-декстрин в гликоген с наружными цепями нормальной длины и, с другой, освобождая глюкозу путем гидролиза ![]() , 6-глюкозидной связи. Мутация фермента сопровождается нарушением высокоспецифического процесса гликогенолиза, приводя к накоплению в тканях (печень, мышцы) молекул гликогена аномальной формы с укороченными наружными цепями, который оказывает цитотоксическое действие, приводя к дисфункции соответствующих органов. Механизмы формирования гипогликемии и лактатацидоза сходны с таковыми при ГБ I типа.
, 6-глюкозидной связи. Мутация фермента сопровождается нарушением высокоспецифического процесса гликогенолиза, приводя к накоплению в тканях (печень, мышцы) молекул гликогена аномальной формы с укороченными наружными цепями, который оказывает цитотоксическое действие, приводя к дисфункции соответствующих органов. Механизмы формирования гипогликемии и лактатацидоза сходны с таковыми при ГБ I типа.
Причиной возникновения ГБ IV типа являются мутации в гене GBE1, кодирующем амило-1, 4:1, 6-глюкантрансферазу, что приводит к ее недостаточности в печени, мышцах, лейкоцитах, эритроцитах и фибробластах. Мутации в этом же гене вызывают полигликозановую болезнь у взрослых. Генный локус ГБ IV типа соответствует 3p12.2. Тип наследования - аутосомно-рецессивный.
Патогенез ГБ IV типа. Амило-1, 4:1, 6-глюкантрансфераза участвует в метаболизме гликогена при точках ветвления гликогенового "дерева". Она соединяет сегмент по крайней мере из шести ![]() , 4-сцепленных глюкозидных остатков наружных цепей гликогена с гликогеновым "деревом"
, 4-сцепленных глюкозидных остатков наружных цепей гликогена с гликогеновым "деревом" 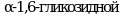 связью. Мутация фермента нарушает нормальный синтез гликогена, что приводит к образованию аномального полисахарида с амилопектиноподобной структурой (полигликозгликан). Накапливаясь в различных тканях, включая печень и мышцы, он повреждает их клетки.
связью. Мутация фермента нарушает нормальный синтез гликогена, что приводит к образованию аномального полисахарида с амилопектиноподобной структурой (полигликозгликан). Накапливаясь в различных тканях, включая печень и мышцы, он повреждает их клетки.
Причиной возникновения ГБ VI типа являются мутации в гене PYGL, кодирующего фосфорилазу печени. Генный локус ГБ VI типа соответствует 14q21.1. Тип наследования - аутосомно-рецессивный.
Патогенез ГБ VI типа. Дефицит печеночной фосфорилазы, катализирующей первую реакцию распада гликогена, ведет к его избыточному накоплению в гепатоцитах.
Причиной возникновения ГБ IXa типа являются мутации гена PHKB2, кодирующего 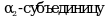 печеночной киназы фосфорилазы, что приводит к ее недостаточности в печени и эритроцитах (подтип IXa1) или только в печени (подтип IXa2). Генный локус ГБ IXa типа соответствует Xp22.13. Тип наследования - X-сцепленный.
печеночной киназы фосфорилазы, что приводит к ее недостаточности в печени и эритроцитах (подтип IXa1) или только в печени (подтип IXa2). Генный локус ГБ IXa типа соответствует Xp22.13. Тип наследования - X-сцепленный.
Причиной возникновения ГБ IXb типа являются мутации гена PHKB, кодирующего 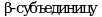 мышечной/печеночной киназы фосфорилазы. Генный локус ГБ IXb типа соответствует 16q12.1. Тип наследования - аутосомно-рецессивный.
мышечной/печеночной киназы фосфорилазы. Генный локус ГБ IXb типа соответствует 16q12.1. Тип наследования - аутосомно-рецессивный.
Причиной возникновения ГБ IXc типа являются мутации гена PHKG2, кодирующего тестикулярную/печеночную изоформу 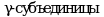 киназы фосфорилазы. Генный локус ГБ IXc типа соответствует 16p11.2. Установлено, что ген PHKG2 содержит 10 экзонов и занимает 9,5 kb геномной ДНК. Тип наследования - аутосомно-рецессивный.
киназы фосфорилазы. Генный локус ГБ IXc типа соответствует 16p11.2. Установлено, что ген PHKG2 содержит 10 экзонов и занимает 9,5 kb геномной ДНК. Тип наследования - аутосомно-рецессивный.
Патогенез ГБ IX типа. Дефицит любой из субъединиц киназы фосфорилазы b нарушает процесс фосфоролиза печеночной фосфорилазы b в фосфорилазу a, что ведет к нарушению активации последней и в итоге - к невозможности расщепления гликогена.
Фосфокиназа состоит из 4 разных субъединиц, каждую из которых кодируют различные гены, располагающиеся в различных хромосомах и по-разному экспрессирующиеся в различных тканях: 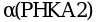 ,
, 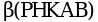 ,
, 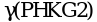 ,
, 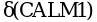 . Субъединицы
. Субъединицы ![]() и
и ![]() выполняют регуляторные функции,
выполняют регуляторные функции, 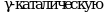 функцию,
функцию, 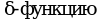 связывания ионов Ca2+. Субъединица
связывания ионов Ca2+. Субъединица ![]() имеет две изоформы - мышечную и печеночную, кодируемые двумя разными генами, располагающимися на X-хромосоме. Гены, кодирующие остальные субъединицы, находятся в аутосомных хромосомах. Мутации в генах PHKA2, PHKAB и PHKG2 вызывают ГБ IXa, IXb и IXc типов, соответственно. При развитии одной из четырех основных форм болезни поражаются соответственно, по убыванию частоты встречаемости, печень, печень и мышцы, только мышцы, только сердце. Имеется также подтип IXd (мышечная форма), вызываемый мутациями в гене PHKA1.
имеет две изоформы - мышечную и печеночную, кодируемые двумя разными генами, располагающимися на X-хромосоме. Гены, кодирующие остальные субъединицы, находятся в аутосомных хромосомах. Мутации в генах PHKA2, PHKAB и PHKG2 вызывают ГБ IXa, IXb и IXc типов, соответственно. При развитии одной из четырех основных форм болезни поражаются соответственно, по убыванию частоты встречаемости, печень, печень и мышцы, только мышцы, только сердце. Имеется также подтип IXd (мышечная форма), вызываемый мутациями в гене PHKA1.
Причиной возникновения ГБ 0 типа являются мутации в генах GYS2 и GYS2, кодирующих печеночную и мышечную гликогенсинтазу, соответственно. Генный локус ГБ 0 типа соответствует: 12p12.1 - для печеночной формы, 19q13.33 - для мышечной. Ген GYS2 содержит 16 экзонов и занимает более 30 kb геномной ДНК. Тип наследования - аутосомно-рецессивный.
Патогенез ГБ 0 типа. При отсутствии гликогенситназы невозможен адекватный синтез гликогена, что приводит к выраженному снижению его содержания в печени или мышцах.
- Гражданский кодекс (ГК РФ)
- Жилищный кодекс (ЖК РФ)
- Налоговый кодекс (НК РФ)
- Трудовой кодекс (ТК РФ)
- Уголовный кодекс (УК РФ)
- Бюджетный кодекс (БК РФ)
- Арбитражный процессуальный кодекс
- Конституция РФ
- Земельный кодекс (ЗК РФ)
- Лесной кодекс (ЛК РФ)
- Семейный кодекс (СК РФ)
- Уголовно-исполнительный кодекс
- Уголовно-процессуальный кодекс
- Производственный календарь на 2025 год
- МРОТ 2026
- ФЗ «О банкротстве»
- О защите прав потребителей (ЗОЗПП)
- Об исполнительном производстве
- О персональных данных
- О налогах на имущество физических лиц
- О средствах массовой информации
- Производственный календарь на 2026 год
- Федеральный закон "О полиции" N 3-ФЗ
- Расходы организации ПБУ 10/99
- Минимальный размер оплаты труда (МРОТ)
- Календарь бухгалтера на 2025 год
- Частичная мобилизация: обзор новостей
- Постановление Правительства РФ N 1875